محتويات
مفهوم طاقة التأين في الجدول الدوري
تُعرف طاقة التأين بأنّها الطاقة اللازمة لإزالة إلكترون من ذرة أو جزيء متعادل الشحنة معزول، حيثُ تختلف طاقة التأين الأولى لكلّ عنصر في الجدول الدوريّ اعتمادًا على حجم الذرة، والتركيب الإلكترونيّ، وتجدر الإشارة أنّ إزالة الإلكترون في الغازات النبيلة أصعب بكثير من إزالته في الفلزات القلويّة، وعليه فإنّ طاقة التأيّن اللازمة لذلك تزداد تدريجيًّا حيثُ تفقد الذرة الإلكترونات.[١]
العوامل التي تعتمد عليها طاقة التأين في الجدول الدوري
تعتمد قيمة طاقة التأيّن اللازمة لإزالة الإلكترون في ذرة متعادلة الشحنة معزولة على الحالة التي يتواجد بها الإلكترون في الذرة، والتي تُعتبر من العوامل المؤثرة في طاقة التأين، وفيما يأتي ذكرها:[٢]
- إذا كان النواة موجبة الشحنة، فإنّ الإلكترونات تنجذب لها بشدة.
- إذا كان الإلكترون يقع بالقرب من النواة، فإنّ الجاذبية ستكون أكبر من الجاذبية عندما يكون الإلكترون بعيدًا.
- إذا كان هناك العديد من الإلكترونات بين المستوى الخارجيّ والنواة، ستكون قوى الجذب أقل.
- إذا كان هناك إلكترونان في نفس المدار، فإنّهما يتنافران بشدة.
حساب طاقة التأين في الجدول الدوريّ
يُمكن حساب طاقة التأيّن في الجدول الدوريّ لذرة في المدار الأول اعتمادًا على الصيغة الآتية:[٢]
طاقة التأين = ثابت بلانك × التردد
وبالرموز:
ط = h × ت
حيثُ إنّ:
- ط: طاقة التأين، وتُحسب بوحدة الجول أو الكيلو جول
- h: ثابت بلانك، ويُساوي 6.6 × 10(34-) جول.ثانية
- ت: التردد، ويُمكن حسابه من الصيغة الآتية: التردد = سرعة الضوء/ الطول الموجيّ، حيثُ إنّ سرعة الضوء تُقدّر بـ 3× 10(8)، ويُقاس التردد بوحدة ث (1-).
كما يُمكن حساب طاقة التأيّن اللازمة لذرة ما في مدار معيّن من خلال الصيغة الآتية:[٢]
طاقة التأين = طاقة التأين للذرة × (1/ (ن 1(2) - (1/ ن 2(2)
حيثُ إنّ:
- ن 1: الرقم الكمي الرئيسي للمدار الأقل في الطاقة.
- ن 2: الرقم الكمي الرئيسي للمدار الأعلى في الطاقة.
- طاقة التأيّن: تُقاس طاقة التأيّن اللازمة لنقل إلكترون من مدار لآخر بوحدة جول/مول.
العلاقات التي يُوضحها الجدول الدوريّ بطاقة التأين
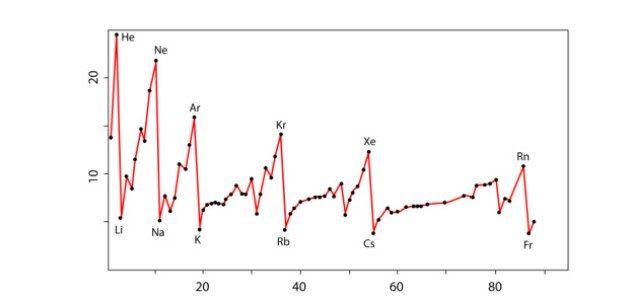
يُظهر ترتيب العناصر الكيميائيّة في الجدول الدوري علاقة ترتبط بطاقة التأين الخاصة بكلّ ذرة، وفيما يأتي توضيحها:[٣]
- تزداد طاقة التأيّن عند الانتقال من اليسار إلى اليمين في الجدول الدوريّ في الدورات والمجموعات، إذ يزداد نصف القطر الذريّ بالانتقال من اليمين لليسار، ويُستثنى من ذلك المجموعة رقم 2، والمجموعة رقم 15.
- تحتاج عناصر المجموعة رقم 2 إلى طاقة تأيّن أكبر من عناصر المجموعة رقم 13، كما تحتاج عناصر المجموعة رقم 15 إلى طاقة تأين أكبر من عناصر المجموعة رقم 16.
- تمتلك المجموعة رقم 2 على مدار مكتمل، كما تمتلك المجموعة رقم 15 مدارًا شبه مكتمل، وهذا بدوره يجعلها تحتاج طاقة تأين أعلى بكثير من المجموعات غير المكتملة.
- تحتاج الفلزات القلويّة إلى طاقة تأين أقلّ من طاقة التأيّن التي تحتاجها الهالوجينات.
- تقلّ طاقة التأيّن عند الانتقال بالمجموعة الواحد في الجدول الدوريّ من أعلى إلى أسفل.
أمثلة على حساب طاقة التأين في الجدول الدوري
يُمكن الاطلاع على الأمثلة الآتية لحساب طاقة التأين لذرات العناصر الآتية:
حساب طاقة التأين لذرة الصوديوم
جد طاقة التأيّن اللازمة لإزالة الإلكترون من ذرة الصوديوم، إذا كان الطول الموجي للإشعاع الكهرومغناطيسيّ لها يُقدر بـ 242 نانوميتر.
الحل:
- جد التردد؛ التردد = سرعة الضوء/ الطول الموجيّ
- التردد = 3× 10(8) / 242 ×10(9-)
- التردد = 0.0124 × 10(17) ث(1-)
- جد طاقة التأين تبعًا للصيغة الآتية:
- طاقة التأين = ثابت بلانك × التردد
- طاقة التأين = 6.6 × 10(34-) × 0.0124 × 10(17)
- طاقة التأين = 8.18 × 10(15) جول/مول
ترتيب العناصر الكيميائيّة حسب طاقة التأين في الجدول الدوريّ
رتب العناصر الكيميائيّة الآتية من أكبر طاقة تأين للأقل: الصوديوم (Na)، والفرانسيوم (Fr)، والليثيوم (Li)، والبوتاسيوم (K).
الحل:
العناصر الكيميائيّة أعلاه تنتمي للمجموعة الأولى، والأعلى طاقة تأين من أعلى المجموعة للأسفل في الجدول الدوريّ كما ذكرنا سابقًا، لذا الترتيب كالآتي:
الليثيوم (Li)، الصوديوم (Na)، البوتاسيوم (K)، الفرانسيوم (Fr).
المراجع
- ↑ Aakanksha Gaur (20/9/2022), "ionization energy", Britannica, Retrieved 2/11/2022. Edited.
- ^ أ ب ت "Ionization Energy", BYJU'S, Retrieved 2/11/2022. Edited.
- ↑ "Ionization Energy", LibreTexts, 4/8/2022, Retrieved 2/11/2022. Edited.