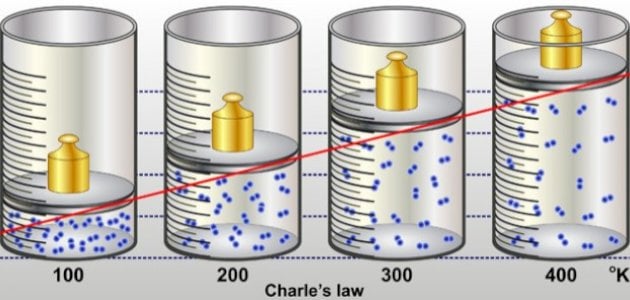
ما هو قانون شارل؟
ينص قانون شارل على أنّ حجم كمية معينة من الغاز تحت ضغط ثابت تتناسب تناسبًا طرديًا مع درجة حرارة الغاز المطلقة، بعبارةٍ أخرى هي دراسة العلاقة التي تربط درجة الحرارة وحجم الغاز عند تثبيت عامل الضغط، وسُميت العلاقة بهذا الاسم نسبةً إلى العالم الفيزيائي شارل.[١]
يُمكن تمثيل قانون شارل عن طريق الصيغة الرياضية الآتية:[٢]
حجم الغاز / درجة حرارة الغاز = ثابت
وبالرموز:
ح / د = ث
حيث إنّ:
- ح: حجم الغاز ويُقاس بوحدة مل.
- د: درجة حرارة الغاز وتُقاس بوحدة كلفن.
- ث: ثابت الغاز، ويُحدّد لكل عينة من الغاز بثبات الضغط ويُقاس بوحدة مل/ كلفن.
يُمكن تمثيل قانون شارل عند تعرض الغاز لظروفٍ متغيرةٍ عن طريق الصيغة الرياضية الآتية:[٢]
الحجم1 / درجة الحرارة1 = الحجم2 / درجة الحرارة2
وبالرموز:
ح1 / د1 = ح2 / د2
حيث إنّ:
- ح1: الحجم الابتدائي للغاز ويُقاس بوحدة اللتر.
- د1: درجة الحرارة الابتدائية للغاز وتُقاس بوحدة الكلفن.
- ح2: الحجم النهائي للغاز ويُقاس بوحدة اللتر.
- د2: درجة الحرارة النهائية للغاز وتُقاس بوحدة الكلفن.
اشتقاق قانون شارل
يُشتق قانون شارل عن طريق الخطوات الآتية:[٣]
- تمثيل العلاقة الطردية بين حجم الغاز ودرجة حرارته عند ثبوت الضغط على النحو الآتي:
ح ∝ د
- تحويل العلاقة الطردية بين حجم الغاز ودرجة حرارته إلى علاقة رياضية، عن طريق استخدام ثابت العلاقة (ث)، كما يأتي:
ح / د = ث
- افتراض أنّ حجم الغاز الابتدائي يُرمز له بالرمز ح1 ، ودرجة حرارته يُرمز لها بالرمز د1، لتُصبح المعادلة كما يأتي:
ح1 / د1 = ث ← (المعادلة الأولى)
- افتراض أنّ حجم الغاز يُرمز له بالرمز ح2 عندما تتغير درجة حرارته، بحيث يرمز للأخيرة بالرمز د2، لتُصبح المعادلة كما يأتي:
ح2/ د2 = ث ← (المعادلة الثانية)
- وضع إشارة المساواة بين المعادليتن الأولى والثانية على النحو الآتي:
ح1 / د1 = ح2 / د2 = ث
- كتابة المعادلة التي تعبّر عن نص قانون شارل كما يأتي:
ح1 / د1 = ح2 / د2
أمثلة عملية على قانون شارل
من التطبيقات العملية على قانون شارل في الحياة ما يأتي:
- طيران المنطاد المُعبأ بالهواء الساخن في الهواء
عند تسخين الهواء في المنطاد ترتفع درجة حرارته، ما يُؤدّي حسب قانون شارل إلى زيادة حجم غاز الهيليوم وانخفاض كثافته، ما يُسبب ارتفاع المنطاد للأعلى، وبالمقابل عند تبريد الهواء في المنطاد تنخفض درجة حرارته، فيقل حجم الغاز وتزيد كثافته، ما يُسبب نزول المنطاد لأسفل.[٤]
- قدرة الرئة على التنفس
يُؤدي انخفاض درجات الحرارة خلال فصل الشتاء إلى خفض قدرة الرئة على التنفس، لأن انخفاض الحرارة حسب قانون شارل يُؤدي إلى تقلّص حجم الغازات بداخلها، وبالتالي انخفاض نسبة الأكسجين بالدم، ولذلك يصعب على اللاعبين الرياضيين ممارسة رياضة الجري في أيام الشتاء شديدة البرودة.[٥]
- تغير حجم كرة القدم
يُؤدي إخراج كرة القدم المنتفخة من المنزل إلى الهواء الطلق في الخارج خلال فصل الشتاء إلى انكماشها قليلًا وتقلّص حجمها، بسبب انخفاض درجة حرارة الغاز المعبأ بداخلها، ما يُؤدّي إلى انخفاض حجمها حسب قانون شارل.[٦]
المراجع
- ↑ "Charles's Law", Chem Libre texts, 30/10/2021, Retrieved 13/11/2021. Edited.
- ^ أ ب " Charles's Law", CHEMISTRY LibreTexts, Retrieved 13/11/2021. Edited.
- ↑ "Charles Law Formula", BYJU'S, Retrieved 13/11/2021. Edited.
- ↑ Anne Helmenstine (4/5/2020), "Charles’s Law – Definition, Formula, Examples", SCIENCE NOTES, Retrieved 13/11/2021. Edited.
- ↑ "Charle's Law", BYJU'S, Retrieved 13/11/2021. Edited.
- ↑ "What are some examples of the gas laws in action in everyday life?", General Chemistry Online, Retrieved 13/11/2021. Edited.