محتويات
ما هو بيروكسيد الهيدروجين؟
يُعرّف بيروكسيد الهيدروجين على أنّه مركّب كيميائي صيغته الكيميائية (H2O2)، وهو سائل عديم اللون يُنتج تجارياً على شكل محاليل بتراكيز مختلفة تتراوح ما بين 35% -90%، ويُستخدم بشكل أساسي في تبييض القطن، والمنسوجات، والصوف، وتصنيع بعض المواد الكيميائية، أو كوقودٍ للصواريخ، بالإضافة إلى ذلك فهو يُستخدم في الصناعات التجميلية، والدوائية، وفي القطاع الصحي، ومن الجدير بالذكر أنّ محاليل بيروكسيد الهيدروجين ذات التراكيز التي تزيد على 8% تُعتبر كاوية للجلد،[١] ويُعرَف بيروكسيد الهيدروجين بعدّة أسماء أخرى، ومنها: ثاني أكسيد الهيدروجين، والبيروكسيد، وهيدروبروكسيد.[٢]
يُعتبر بيروكسيد الهيدروجين من أبسط عناصر مجموعة الأكاسيد الفوقية، كما يُذكر أنّه اكتُشِف لأوّل مرة سنة 1818م، ويَنتج بيروكسيد الهيدروجين عند تفاعل الأكسجين الموجود في الجو ببعض المركبات العضوية، مثل: كحول الإيزوبروبانول (بالإنجليزية: Isopropyl Alcohol)، والأنثراكينون (بالإنجليزية: Anthraquinone)، ومن الجدير بالذكر أنّه تُضاف إليه بعض المُثبّتات؛ كأملاح القصدير والفوسفات للحد من تفكّكه أو اضمحلاله.[١]
يتوفر بيروكسيد الهيدروجين بنسب قليلة في الطبيعة، حيث يَنتج عند تفاعل عنصر الأكسجين الموجود في الهواء مع الماء، بالإضافة لكونه مُنتجاً ثانوياً لتفاعلات عمليات الأيض التي تحدث في خلايا النباتات والحيوانات، ويجدر بالذكر أنّ الكميات الضخمة المستخدمة في الصناعة من بيروكسيد الهيدروجين تُنتج بالاعتماد على سلسلة طويلة من التفاعلات الكيميائية المعقدة التي تبدأ بمادة من عائلة الألكيل مثل مادة ألكيل أنثراهيدروكينون (بالإنجليزية: Alkyl Anthrahydroquinones) التي تتكون من ارتباط 3 مركبات حلقية لها القدرة على التحول من شكل فراغي إلى آخر، أو من خلال التحليل الكهربائي لحمض الكبريتيك، أو تسخين كحول الإيزوبروبانول.[٢]
خصائص بيروكسيد الهيدروجين
تتشابه خصائص بيروكسيد الهيدروجين الفيزيائية مع خصائص الماء الفيزيائية؛ فدرجة انصهاره تُساوي 0.4-° ودرجة انصهار الماء تُساوي صفر، على الرغم من أنّ درجة الغليان تُساوي 150° للبيروكسيد و 100° للماء، مع التشديد على أنّ درجة غليان البيروكسيد حُسبت نظرياً فقط؛ فلا يُمكن رفع حرارة بيروكسيد الهيدروجين لتلك الدرجة لما يتسبب به من انفجارات ستنتهي بتحلله إلى ماء وأكسجين.[٣]
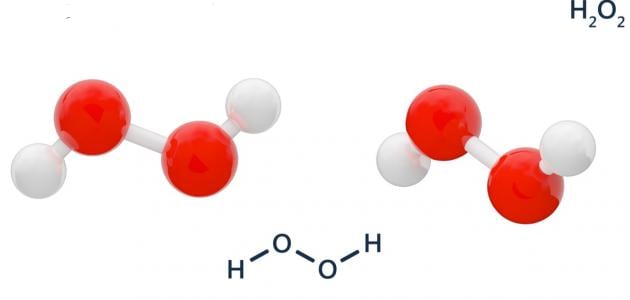
يحتوي بيروكسيد الهيدروجين على ذرتي أكسجين ترتبط كلّ منها بالأخرى، وكلّ ذرة أكسجين ترتبط من جانبها الآخر بذرة هيدروجين؛ ممّا يجعل الشكل الفراغي لبيروكسيد الهيدروجين ملتوياً وبعيداً كل البعد عن الشكل الفراغي المستوي؛ حيث تُساوي زاوية الرابطة بين ذرة الهيدروجين وذرة والأكسجين 102 درجة، ويُعتبر بيروكسيد الهيدروجين عاملاً مؤكسداً قوياً، وعليه فلا يُمكن أن يكون عاملاً مُختزلاً إلا بوجود عامل مؤكسد أقوى منه، مثل أكسيد المغنيسيوم، ويفقد بيروكسيد الهيدروجين إحدى ذرتي الأكسجين التي لديه أثناء عمله كعامل مؤكسد؛ فينتج الماء كمنتج ثانوي لذلك التفاعل،[٣] وتُساوي كتلته المولية 34.02 غم/مول، كما أنّ ذائبيته عالية في الماء والإيثرات.[٢]
تحضير بيروكسيد الهيدروجين
يُحضّر بيروكسيد الهيدروجين بعدّة طرق، وذلك تِبعاً للسبب الذي يُحضّر من أجله كما يأتي:[٤]
- التحضير المخبري: يُحضّر بيروكسيد الهيدروجين في المختبر عن طريق رفع درجة حموضة أكسيد الباريوم، وإزالة الماء الناتج أثناء التفاعل من خلال التبخير تحت ضغط منخفض، وتُوضّح المعادلة الكيميائية الآتية التفاعل:
- BaO2.8H2O(s) + H2SO4(aq) → BaSO4(s) + H2O2(aq) + 8H2O(l)
- التحضير الصناعي: يُمكن تحضير بيروكسيد الهيدروجين صناعياً عن طريق التحليل الكهربائي لنسبة 30% من حمض الكبريتيك المثلّج، فعند رفع درجة حموضة محلول السلفات يتحلل كهربائياً تحت تيار كهربائي عالٍ مُنتجاً بيروكسيد السلفات، والذي يتحلل مائياً بدوره مُنتجاً بيروكسيد الهيدروجين كما في المعادلة التالية:
- 2HSO-4(aq) [Electrolysis] → HO3SOOSO3H(aq) [Hydrolysis] → 2HSO-4(aq)+2H+(aq)+H2O2(aq)
- التحضير التجاري: يُحضّر بيروكسيد الهيدروجين بكميات تجارية عن طريق عملية الأكسدة التلقائية.[٤]
فوائد واستخدامات بيروكسيد الهيدروجين
يوجد العديد من الفوائد والاستخدامات لبيروكسيد الهيدروجين، من أهمها ما يأتي:[٥]
- يُستخدم بيروكسيد الهيدروجين في تنظيف الجروح؛ إذ يُرطبها ويُنظفها من الشوائب العالقة والأنسجة الميتة والدماء المُتخثرة، كما يقتل الخلايا الليفية مما يُساعد في بناء الأنسجة المُتضررة؛ أيّ شفاء الجروح، ويجدر بالذكر أنّه غير مناسب للاستخدام لفترة طويلة لذات السبب.
- يُستخدم كمطهر فموي؛ حيث يُعدّ بيروكسيد الهيدروجين فعالاً في مُحاربة بكتيريا المكورات العقدية التي تفتقر لإنزيمات الكاتالاز (بالإنجليزية: Catalase)، كما يُستخدم كعامل مُساعد في إعاقة نمو البكتيريا اللاهوائية في الفم.
- يُستخدم في تبييض الأسنان.
- يُستخدم كمُضاد للبكتيريا وكعامل مؤكسد.[٦]
- يُستخدم في صناعة مستحضرات العناية الشخصية مثل معجون الأسنان والملونات؛ حيث يُعطي تأثيراً مُبيضاً.[٦]
- يُستخدم في القطاع الصحي؛ كعامل للتنظيف، فخلال جائحة كورونا مثلاً أجازت هيئة الغذاء والدواء الأمريكية استخدام بيروكسيد الهيدروجين المستقر في الحالة الغازية لتعقيم أجهزة التنفس الصناعي وأجهزة الحماية الشخصية المُستعملة من قِبل مرضى كورونا (بالإنجليزية: Covid-19).[٦]
فترة صلاحية بيروكسيد الهيدروجين
يُمكن حفظ بيروكسيد الهيدروجين في علبة مُحكمة الإغلاق، إذ يضمحل المحلول ذو تركيز 3% مثلاً بمعدل 0.5% سنوياً في الظروف العادية وفي درجة حرارة الغرفة، لكن بمجرد فتح العلبة يُنصح باستهلاك مُحتوياتها في أقصر وقت ممكن؛ لأنّه يبدأ بالتحلل بمُجرد تعرضه للهواء مُنتجاً الماء، وعليه لا يعود استخدامه فعالاً كمُطهّر، كما يُمكن أن يُصبح استخدامه خطراً إذا تلوّث، ومن الجدير بالذكر أنّه في حال عدم التأكد من صلاحية العلبة؛ فإنّه يُمكن فحصها بطريقة آمنة برش القليل من محتوياتها في المغسلة، ومراقبة حالة السائل؛ ففورانه يعني أنّها صالحة للاستخدام ولم تضمحل بعد.[٧]
المراجع
- ^ أ ب "Hydrogen peroxide", www.britannica.com, Retrieved 2021-4-22. Edited.
- ^ أ ب ت "Hydrogen Peroxide", www.encyclopedia.com,2018-5-18، Retrieved 2021-4-22. Edited.
- ^ أ ب Laura Foist, "Hydrogen Peroxide: Preparation, Properties & Structure"، study.com, Retrieved 2021-4-22. Edited.
- ^ أ ب "What is Hydrogen Peroxide (H2O2)?", byjus.com, Retrieved 2021-4-22. Edited.
- ↑ Alex Silbajoris (2018-3-10), "Does Hydrogen Peroxide Kill Bacteria?"، sciencing.com, Retrieved 2021-4-22. Edited.
- ^ أ ب ت "Hydrogen Peroxide", www.chemicalsafetyfacts.org, Retrieved 2021-4-22. Edited.
- ↑ Anne Marie Helmenstine (2020-7-4), "Hydrogen Peroxide Shelf Life"، www.thoughtco.com, Retrieved 2021-4-22. Edited.