محتويات
نظرة عامة حول العدد الكتلي
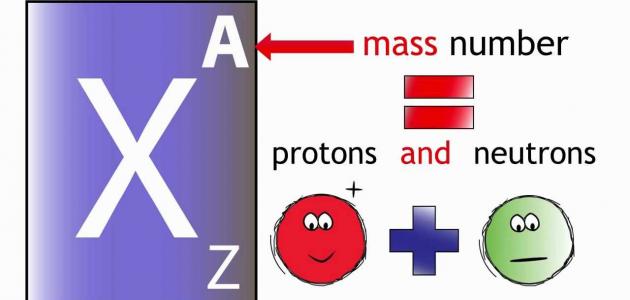
يُعبّر العدد الكتلي عن مجموع عدد البروتونات والنيوترونات الموجودة داخل نواة ذرّة العنصر،[١][٢] ويُرمز له بالرمز (A)، فالعدد الكتلي لأيّة ذرّة يُساوي الكتلة الذريّة مقرّبةً إلى أقرب عدد صحيح، ويتمّ استخدام العدد الكتلي لتنظيم جدول النظائر (بالإنجليزية: Chart of nuclides)، وقد وجد العلماء من خلال الأبحاث العلمية ذرّات لها العدد الذريّ نفسه لكنّها تختلف في العدد الكتلي فأطلقوا عليها اسم النظائر (بالإنجليزية: Isotopes)، مثل: 168O ،178O، 188O، وعند التعبير عن العنصر بكتابة العدد الذريّ والعدد الكتلي له فإنّ العدد الذريّ يُكتب إلى الأسفل من يسار رمز العنصر، والعدد الكتلي يكتب إلى الأعلى من يسار رمز العنصر (AZX)، مثال: النيتروجين عدده الكتلي يُساوي 14 وعدد البروتونات فيه يُساوي 7، لذا فإنّه يكتب على النحو الآتي: (147N).[١]
هناك فرق بين مفهومي العدد الذريّ والعدد الكتلي، حيث يُمثّل العدد الذريّ عدد البروتونات في الذرّة، ويرمز له بالرمز (Z)،[١] وتكمن أهميته في تحديد هوية عنصر معين وخصائصه الكيميائيّة؛ ذلك لأنّ عدد البروتونات يُساوي عدد الإلكترونات في الذرّة المتعادلة، كما أنّ عدد البروتونات للعنصر الواحد يكون ثابتاً دائماً ولا يتغيّر، أيّ أنّ العدد الذريّ هو ذاته لكلّ الذرات المكوّنة للعنصر، وفي حال تغيّر العدد الذريّ فإنّ العنصر بأكمله يتغيّر؛ فعلى سبيل المثال تحتوي ذرات الأكسجين على 8 بروتونات، وبالتالي فالعدد الذريّ للأكسجين هو 8، وفي حال تغيّر هذا العدد فإنّ الذرة لا تكون ذرة أكسجين.[٣]
حساب العدد الكتلي
يُمكن حساب العدد الكتلي لأيّ عنصر من خلال المعادلة الرياضيّة الآتيّة: العدد الكتلي= عدد البروتونات + عدد النيوترونات،[٤] حيث إنّ كتلة الإلكترونات لا تدخل في حساب العدد الكتلي؛ نظراً لكُتلتها الصغيرة جداً، كما يُمكن معرفة عدد النيوترونات من خلال طرح العدد الذريّ من العدد الكتلي أيّ أنّ: عدد النيوترونات= العدد الكتلي - العدد الذريّ،[٥] وفيما يأتي أمثلة توضيحية:
- مثال(1): عدد البروتونات في ذرة الهيليوم(He) هو 2، وعدد النيوترونات هو 2، فما هو العدد الكتلي للهيليوم؟[٣]
- الحل: العدد الكتلي= عدد البروتونات + عدد النيوترونات، وبالتالي فإنّ العدد الكتلي= 2 + 2 = 4.
- مثال(2): ما هو العدد الكتلي لعنصر الليثيوم (Li)، إذا كانت عدد البروتونات فيه 3 وعدد النيوترونات 4؟[٣]
- الحل: العدد الكتلي= عدد البروتونات + عدد النيوترونات، فإنّ العدد الكتلي= 3 + 4، وبالتالي العدد الكتلي يُساوي 7.
- مثال(3): ما هو عدد النيوترونات في ذرة الكروم (Cr)، التي عددها الذريّ 24 وعددها الكتلي 52؟[٣]
- الحل: يُمكن الحصول عل عدد النيوترونات من خلال طرح العدد الذريّ من العدد الكتلي، أيّ أنّ عدد النيوترونات= 52 - 24= 28 نيوتروناً.
- مثال(4): ذرة عددها الكتلي 32 وعددها الذري 16، فما هو عدد النيوترونات فيها؟[٦]
- الحل: بما أنّ العدد الذري يُساوي عدد البروتونات، والعدد الكتلي= عدد البروتونات + عدد النيوترونات، فإنّ 32= 16 + عدد النيوترونات، وبالتالي فإنّ عدد النيوترونات= 32 - 16 = 16 نيوتروناً.
- مثال(5): ذرة عددها الذريّ 11، وعدد النيوترونات فيها 12، فما هو العدد الكتلي لها؟[٦]
- الحل: بما أنّ العدد الذريّ يُساوي عدد البروتونات، فإنّ عدد البروتونات يُساوي 11، إذن العدد الكتلي= عدد البروتونات + عدد النيوترونات، وبالتالي العدد الكتلي= 11 + 12 = 23.
- مثال(6): ذرة عددها الذريّ 9 وعددها الكتلي 19، فما هو عدد البروتونات، وعدد الإلكترونات، وعدد النيوترونات فيها؟[٧]
- الحل:
- عدد البروتونات هو 9؛ لأنّ عدد البروتونات يُساوي دائماً العدد الذري.
- عدد الإلكترونات هو 9؛ وذلك لأنّ عدد البروتونات يُساوي عدد الإلكترونات في الذرة المتعادلة.
- عدد النيوترونات هو 10؛ وذلك لأنّ عدد النيوترونات يُمكن الحصول عليه من خلال طرح العدد الذريّ من العدد الكتلي، أيّ أنّ (عدد البروتونات + عدد النيوترونات) - (عدد البروتونات) = عدد النيوترونات.
- الحل:
الفرق بين العدد الكتلي والكتلة الذرية
هناك فرق بين العدد الكتلي والكتلة الذريّة؛ فالعدد الكتلي يُعبّر عن عدد البروتونات والنيوترونات معاً داخل نواة العنصر، بينما تُعبّر الكتلة الذريّة عن كتلة الذرّة أيّ متوسط كتلة البروتونات والنيوترونات لنظائر العنصر الموجودة في الطبيعة،[٨] كما أنّ العدد الكتلي دائماً يكون عدد صحيح؛ لأنّه يُمثّل إجمالي عدد البروتونات والنيوترونات معاً، أمّا الكتلة الذريّة لا يُمكن أن تكون عدداً صحيحاً إنّما تكون أعداد عشرية؛ إذ أنّها تُعبّر عن الكتلة الدقيقة للذرّة، ويتمّ التعبيرعن الكتلة الذريّة بوحدة كتلة ذريّة (amu)، حيث إنّ وحدة الكتلة الذريّة الواحدة تُمثّل 1/12 من كتلة ذرّة الكربون-12، 12C، أيّ أنّ الكتلة الذريّة بالغرام تُساوي (←1.66× 10-24)؛[٩] فمثلاً ذرّة الكربون-12، تحتوي على 6 نيوترونات، وبالتالي فإنّ كتلها الذريّة تساوي 12 وحدة كتلة ذريّة؛ حيث لا يوجد أيّ نظير له كتلة على هيئة عدد صحيح غير الكربون-12.[٤]
يُمكن اعتبار الكتلة الذريّة مطابقة حسابياً للعدد الكتلي الخاص بالعنصر مع وجود بعض الاختلافات في المنازل العشرية؛ وسبب هذا الاختلاف يعود إلى سببين رئيسييّن هما كالآتي: لا يُمكن أن تزن البروتونات والنيوترونات وحدة كتلة ذريّة واحدة (amu)، حيث إنّ البروتون يزن 1.0072765 وحدة كتلة ذريّة، والنيوترون يزن 1.0086650 وحدة كتلة ذريّة، والسبب الثاني يكمن في كون البروتونات والنيوترونات تكون مرتبطةً مع بعضها البعض كنواة ذريّة ممّا يجعل كتلة النواة أقل من المجموع الكتلي للبروتونات والنيوترونات فيها،[٩] ومن الجدير بالذكر أنّ العلماء وضعوا مصطلح الكتلة الذريّة النسبية (بالإنجليزية: Relative Atomic Mass)، والتي يُطلق عليها أحياناً مصطلح الوزن الذريّ (بالإنجليزية: Atomic Weight)؛ وهي متوسط الكتل الذريّة لكلّ النظائر المختلفة الموجودة في عيّنة عنصر ما؛ حيث إنّ النظائر لها كتل ذريّة مختلفة لنفس العنصر.[٤]
المراجع
- ^ أ ب ت Allison Campbell, Jason Donev (2018-6-4), "Mass number"، energyeducation.ca, Retrieved 2020-7-23. Edited.
- ↑ The Editors of Encyclopaedia Britannica (2007-2-6), "Mass number"، www.britannica.com/, Retrieved 2020-7-22. Edited.
- ^ أ ب ت ث Elizabeth Gordon (2020-2-26), "Atomic Mass and Atomic Number"، chem.libretexts.org, Retrieved 2020-7-22. Edited.
- ^ أ ب ت "Atomic number, atomic mass, and isotopes", www.khanacademy.org, Retrieved 2020-7-22. Edited.
- ↑ "Atomic Number and Mass Number", www.courses.lumenlearning.com, Retrieved 2020-7-22. Edited.
- ^ أ ب "Mass Number of an Atom Chemistry Tutorial", www.ausetute.com.au, Retrieved 2020-7-22. Edited.
- ↑ "Atomic Number and Mass Number", www.byjus.com, Retrieved 2020-7-22. Edited.
- ↑ Todd Helmenstine (2020-2-4), "Atomic Mass Versus Mass Number"، www.thoughtco.com, Retrieved 2020-7-22. Edited.
- ^ أ ب Robert L. Wolke (2020-7-12), "Mass Number"، www.encyclopedia.com, Retrieved 2020-7-22. Edited.