محتويات
التفاعلات الكهروكيميائية
تعرف التفاعلات الكهروكيميائية بأنّها عملية مرور تيار كهربائي بين مادتين تشتمل على نقل الإلكترونات، بحيث تكون إحدى المادتين صلبة والأخرى سائلة، ويكون حدوث التفاعل الكيميائي مصحوبًا بامتصاص الحرارة أو تحريرها، وهناك نوعان من التفاعلات الكهروكيميائية تتضمن التفاعل التلقائي؛ وهو تحويل الطاقة الكيميائية إلى كهربائية والتفاعل غير التلقائي الذي يحدث باستخدام طاقة كهربائية وتحويلها إلى كيميائية، وسيذكر في هذا المقال تعريف الخلية الكهروكيميائية.[١]
تعريف الخلية الكهروكيميائية
تعرف الخلايا الكهروكيميائية بأنّها أجهزة تستخدم مبادئ الكيمياء الكهربائية أي التفاعلات كيميائية لتوليد التيارات الكهربائية بين الأقطاب أو بالعكس، وتستخدم هذه الخلايا في العديد من أجهزة الكمبيوتر والهواتف المحمولة لجعل الحياة أسهل وأكثر متعة، ولهذه الخلايا نوعان هما: الخلايا الغلفانية وخلايا التحليل الكهربائي، وسيتم تعريف الخلية الكهروكيميائية بنوعيها فيما يأتي:[٢]
خلايا التحليل الكهربائي
تقوم خلايا التحليل الكهربائي بدفع التفاعلات الكيميائية عن طريق تمرير طاقة كهربائية، وتتألف هذه الخلايا من قطبين، يُعرف القطب الذي يفقد عنده الإلكترونات من خلال حدوث عملية التأكسد باسم المصعد والقطب الذي يكتسب الإلكترونات بحدوث الاختزال بالمهبط في مصهور كهرلي وعادة ما يكون هذا المصهور محلول ملحي، ويتم توصيل التيار الكهربائي بالأقطاب الكهربائية مما يوفر طاقة تدفع التفاعل الكيميائي في المحلول والتي تسمى بعملية التحليل الكهربائي وكمثال على ذلك التحليل الكهربائي لمحلول كلوريد الصوديوم NaCl، حيث يتم غمر القطبين في المحلول المنصهر ومن ثم تحدث تفاعلات كيميائية في كل قطب مما يؤدي إلى ضخ الإلكترونات بواسطة مصدر الطاقة من قطب كهربائي إلى آخر فيتم بذلك الحصول على أيون الصوديوم الموجب وغاز الكلور أي الحصول على طاقة كيميائية.
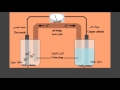
الخلايا الجلفانية
تستخدم الخلايا الجلفانية أو الخلايا الفولتية تفاعلات التأكسد والاختزال الكيميائية بدلًا من التفاعل الكيميائي الناتج عن الكهرباء؛ لإنتاج الطاقة الكهربائية، وعلى سبيل المثال عند تكوين خلية جلفانية في وعاء واحد يحدث فيه تفاعل التأكسد والاختزال بين المحاليل المائية للزنك والنحاس مثلًا ويتم ذلك بحدوث تأكسد للزنك واختزال للنحاس فينتج عن ذلك تدفق للإلكترونات عبر السلك المتصل بالقطبين والمشكلة بأنّ هذا التدفق عندما يصبح محلول الزنك موجب الشحنة ومحلول النحاس سالب الشحنة سيتوقف ولاستمرار ذلك يتم وضع أنبوب على شكل حرف U مملوء بمحلول ملح مركز مما يوفر ذلك المحلول الموجود في الأنبوب الفرصة لانتقال الأيونات وهذا يتيح التدفق المستمر للإلكترونات.
تطبيقات على الخلية الكهروكيميائية
تعد البطارية من التطبيقات المهمة على الخلية الكهروكيميائية، فهي موجودة في كل مكان ويعتمد عليها العالم الحديث كمصدر للطاقة المحمولة، حيث أنّها توجد في الأجهزة المحمولة وأجهزة السمع والسيارات، وتحتوي البطاريات على ثلاثة أجزاء رئيسة هي: الفاصل وهي مادة تفصل القطب الموجب عن القطب السالب وتمنع حدوث تلامس بينهما، الكهرل والأقطاب الكهربائية المصنوعة من مواد موصلة ويسمى القطب الموجب فيها بالمهبط وهو المكان الذي تدخل فيه الإلكترونات أثناء التفريغ، وأما عن قطبها السالب فيسمى بالمصعد وهو المكان الذي تصعد منه الإلكترونات، وتتكون هذه الأقطاب وما بينها من مادة سائلة تحتوي على جزيئات أو أيونات مشحونة بالكهرباء بحيث أنّ هذه الأيونات تتحد مع تلك المواد التي تتكون منها الأقطاب مما يؤدي إلى إنتاج تفاعلات كيميائية تسمح للبطارية بتوليد تيار كهربائي[٣]كما أنّ عملية استخلاص المعادن تعد أيضًا من التطبيقات المهمة للخلية الكهروكيميائية، فمثلًا يتم الحصول على النحاس عن طريق التحليل الكهربائي في محلول سلفات النحاس المائي، ويتم أيضًا استخلاص الألومنيوم والتيتانيوم والمعادن القلوية من الأملاح المنصهرة عن طريق الترسيب الكهربائي[١].
المراجع
- ^ أ ب "Electrochemical reaction", www.britannica.com, Retrieved 8-7-2019. Edited.
- ↑ "What is an Electrochemical Cell? - Structure & Uses", study.com, Retrieved 8-7-2019. Edited.
- ↑ "How Do Batteries Work?", www.livescience.com, Retrieved 8-7-2019. Edited.