محتويات
نص قانون بويل في الفيزياء
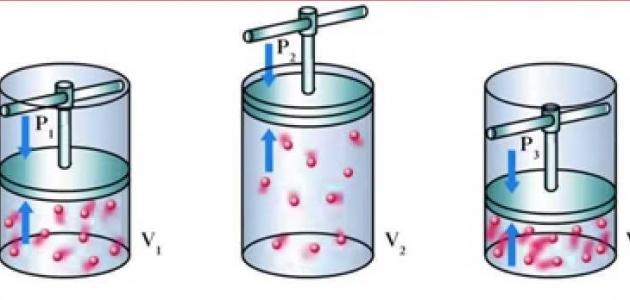
يُعرّف قانون بويل أيضاً بقانون ماريوت، ويُوضّح القانون العلاقة ما بين الضغط وتمدّد الغاز عند درجة حرارة ثابتة، حيث أوجد العالِم الفيزيائي روبرت بويل قانون بويل الذي ينصّ على أنّ العلاقة بين الضغط لكمية معيّنة من الغاز تتناسب عكسياً مع حجمه عند درجة حرارة ثابتة.[١]
يُشير قانون بويل إلى العلاقة العكسية بين حجم كتلة معيّنة من الغاز والضغط الواقع عليه، وذلك عند تثبيت درجة الحرارة، ويُمكن ملاحظة ذلك عند عملية الشهيق، حيث يزداد حجم الرئة وينخفض الضغط فيها في نفس الوقت، ونتيجةً لذلك يندفع الهواء ويملأ الرئة.[٢][٣]
الصيغة الرياضية لقانون بويل
اعتماداً على نصّ قانون بويل الذي يُوضّح العلاقة بين حجم الغاز والضغط، فإنّ أي تغيّر في الحجم الذي يشغله الغاز سيُؤدّي إلى تغيّر في الضغط الذي يُمارسه الغاز وذلك عند درجة حرارة ثابتة، وبعبارة أخرى فإنّ ناتج الضغط الأولي والحجم الأولي للغاز يساوي ناتج ضغطه وحجمه النهائي بثبات درجة الحرارة، حيث عبّر بويل عن ذلك من خلال المعادلات الآتية:[٤]
P1V1 = P2V2
P2V2=K ، P1V1=K
وتُكتب صيغة القانون كالآتي:[١]
k=pv
حيث تعبر الرموز عن كل مما يلي:
- (P): الضغط.
- (V): الحجم.
- (K): ثابت الغاز.
يُوضّح المثال الآتي آلية تطبيق قانون بويل لحساب الحجم:[٥]
- بالون حجمه 2 لتر من الغاز، مُعرّض لضغط مقداره 3 ضغط جوي، إذا انخفض الضغط إلى 0.5 ضغط جوي مع ثبات درجة الحرارة، فكم يكون حجم البالون الجديد؟ يُمكن اتّباع الخطوات الآتية للوصول إلى الحجم الجديد:
- PiVi = PfVf
- تُمثّل Pi الضغط الأولي، و Vi الحجم الأولي، وتُمثّل Pf الضغط النهائي، و Vf الحجم النهائي.
- وبالتعويض في المعادلة ينتج حجم البالون الجديد وهو 12 لتر.
اشتقاق قانون بويل
يتم اشتقاق قانون بويل كالآتي:[٦]
- يعتمد ثابت التناسب على كمية الغاز ودرجة حرارة الغاز، كما ويتم التعبير عنه بوحدات معينة وثابتة.
- يكون ناتج الضغط والحجم لكمية ثابتة ومعينة من الغاز ثابتاً، وذلك شريطة ثبوت درجة الحرارة.
- يتناسب الضغط الذي تمارسه كمية ثابتة من الغاز (عدد المولات) عكسياً مع الحجم، وذلك مع ثبات درجة الحرارة.
- إذا كانت كمية ثابتة من الغاز عند درجة حرارة ثابتة تشغل الحجم V1، عند ضغط مقداره P1، وتخضع للتمدد، يصبح حينها الحجم V2، ويصبح الضغط P2.
- نتيجة لهذا الثبات فإن قانون بويل ينص على أن؛ ( الثابت= P1V1 = P2V2 )
أمثلة حسابية على قانون بويل
وفيما يأتي أمثلة حسابية متنوعة على قانون بويل:
المثال الأول: إذا علمت أن أحمد لديه بالون مملوء بالهيدروجين في درجة حرارة الغرفة، سوف ينفجر هذا البالون إذا تجاوز الضغط 0.3 ضغط جوي، ما الحجم الذي سوف يتمدد به هذه البالون إذا احتل الغاز عند ضغط 1 ضغط جوي ما نسبته 2.7 لتر؟
الحل:
- يتبين من المعطيات أن الضغط الأول P1 يساوي 1 ضغط جوي، وأن الحجم حينها V1 يساوي 2.7 لتر.
- ينفجر البالون عند الضغط الثاني P2 والذي يساوي 0.3 ضغط جوي.
- بتعويض المعطيات بالقانون؛ P1V1 = P2V2، يتبين أن V2 يساوي ناتج قسمة P1 V1 على P2
- ومنه؛ 0.3/ (V2 =(1 × 2.7
- يتبين بعد حساب المعادلة أن؛ V2 يساوي 9 لتر.
المثال الثاني: يحاول خالد نقل الغاز من عبوة لأخرى، مع ثبات درجة الحرارة أثناء عملية النقل والتي كانت 23 درجة مئوية، حيث كانت سعة العبوة الأولى 3 لتر وضغط الغاز فيها 1.5 ضغط جوي، في حين أنّ سعة العبوة الأخرى 6 لتر، فماذا سيكون ضغط الغاز حينها؟
الحل:
- يتبين من المعطيات أن V1 يساوي 3 لتر، وأن P1 يساوي 1.5 ضغط جوي، في حين أن V2 يساوي 6 لتر.
- بتعويض المعطيات بالقانون، P1V1 = P2V2، ينتج أن P2 يساوي ناتج قسمة P1 V1 على V2
- ومنه؛ P2= (1.5 × 3) / 6
- يتبين بعد حساب المعادلة أن؛ P2 يساوي 0.75 ضغط جوي.
المثال الثالث: احسب الحجم النهائي لبالون حجمه 0.8 لتر وضغطه 2 ضغط جوي، إذا انخفض ضغطه إلى 1 ضغط جوي، مع بقاء درجة الحرارة ثابتة.
الحل:
- يتبين من المعطيات أن الضغط الأول P1 يساوي 2 ضغط جوي، وأن الحجم حينها V1 يساوي 0.8 لتر.
- ينخفض البالون عند الضغط الثاني P2 والذي يساوي 1 ضغط جوي.
- بتعويض المعطيات بالقانون، P1V1 = P2V2، يتبين أن V2 يساوي ناتج قسمة P1 V1 على P2
- ومنه؛ 0.3/ (V2 =(2 × 0.8
- يتبين بعد حساب المعادلة أن؛ V2 يساوي 5.33 لتر.
تطبيقات عملية على قانون بويل
تتعدّد التطبيقات العملية لقانون بويل، ومن أبرزها ما يأتي:[٧]
- موت الأسماك عند خروجها إلى سطح البحر
وذلك لأنّ الضغط ينخفض كثيراً عند خروجها للسطح، فيزيد هذا من حجم الغازات الموجودة في الدم، وبالتالي يُؤدّي إلى موت الأسماك.
- عملية الغوص
فعندما يغوص الغوّاص في عمق المياه يزداد الضغط المُحيط بالمياه، وينتج عن زيادة الضغط زيادة في قابلية ذوبان الغازات في الدم، وعند خروج الغوّاص إلى السطح مباشرةً، فإنّ الضغط يقلّ وتتوّسع الغازات في جسم الغوّاص بسرعة، ممّا يُؤدّي إلى جعل الدم أشبه بالمحلول الرغوي، ممّا يتسبّب في حدوث آلام شديدة، ويُمكن تجنّب ذلك بخروج الغوّاص ببطء إلى سطح المياه.
- الحُقنة الطبية
وذلك لأنّه عند الضغط على المكبس يقلّ حجم السائل في الأنبوبة، ممّا يُؤدّي إلى زيادة الضغط على السائل، فيجعله يندفع نحو الخارج، وبهذه الطريقة يتمّ حقن المريض وإدخال السائل للجسد.
- رئة الإنسان
إذ ينتج عن تمدّد الرئتين انخفاض مُؤقّت في الضغط، فيكون الضغط داخل الجسم أقل من الضغط الخارجي، وبالتالي يُؤدّي إلى دخول الهواء المحيط بالجسم إلى الداخل، حيث تُدعى هذه العملية بالشهيق، وعندما تسترخي الرئتان، يقلّ حجمها، ممّا يزيد الضغط مُؤقتّاً مقارنةً بالخارج، فيخرج الهواء في عملية الزفير.
- مضخّة الدراجة اليدوية
تُشابه سلوك الحُقنة تقريباً، حيث ينتج عن دفع مقبض المضخة للأسفل زيادة الضغط داخلها، وبالتالي يتمّ دفع هذا الغاز المضغوط داخل الإطار، وبهذا تتمّ عملية نفخ الإطارات.
قانون بويل هو أحد قوانين الغازات، وهو يربط ما بين حجم الغاز وضغطه عند ثبات درجة الحرارة، وقد وجده العالم روبرت بويل لذلك سمي على اسمه، وينص القانون على أن حجم كمية محددة من الغاز تتناسب عكسياً مع الضغط الواقع عليه شريطة ثبوت درجة الحرارة.
يشار إلى أن هناك العديد من التطبيقات العديدة والمختلفة من واقع الحياة التي تعبر عن هذا القانون؛ كرئة الانسان، والدراجة الهوائية، والحقنة الطبية، وغيرها الكثير.
المراجع
- ^ أ ب "Boyle's law", www.britannica.com,2019-11-20، Retrieved 2021-5-10. Edited.
- ↑ "Boyle's law", www.osmosis.org, Retrieved 2021-5-10. Edited.
- ↑ "Boyle's Law", chem.libretexts.org,2021-4-30، Retrieved 2021-5-10. Edited.
- ↑ "Boyle’s Law", byjus.com, Retrieved 2021-5-11. Edited.
- ↑ Anne Helmenstine (2020-1-30), "Boyle's Law Explained With Example Problem"، www.thoughtco.com, Retrieved 2021-5-11. Edited.
- ↑ "Boyle’s Law: Definition, Statement, Derivation, Detailed Explanation, Examples", embibe, Retrieved 4-9-2021. Edited.
- ↑ "Real-life Examples of Boyle's Law", chemistrygod.com,2019-11-1، Retrieved 2021-5-12. Edited.