محتويات
قانون دالتون للضغوط الجزئية
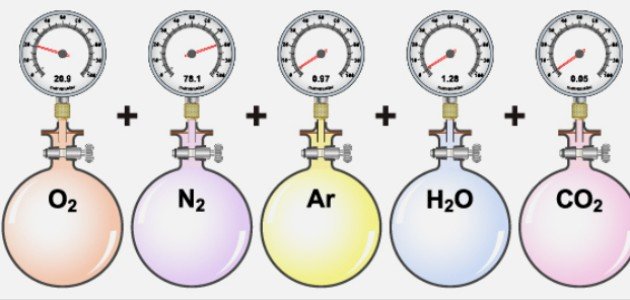
ما هو قانون دالتون للضغوط الجزئية؟ ينص قانون دالتون على أن الضغط الكلي لمزيج من الغازات يساوي مجموع الضغوط الجزئية للغازات المكونة لهذا المزيج، ويعني الضغط الجزئي هنا الضغط الذي يسببه أي غاز عند وضعه لوحده في نفس وحدة الحجم، التي يوجد فيها المزيج وعند نفس درجة الحرارة، ويعود الفضل في التوصل إلى هذه النظرية إلى العالِم الإنجليزي جون دالتون الذي توصل إلى العلاقة التجريبية بين الغاز من جهة والحجم من جهة أخرى في عام 1801م.[١]
اشتقاق قانون دالتون للضغوط الجزئية
قد اشتق قانون دالتون من النظرية الحركية للغازات بعد افتراض أن هنالك غازًا مثاليًا بالفعل وافتراض أن التفاعلات الكيميائية بين الغازات المكونة للخليط لم تحدث، لكن القانون مطبق بفاعلية وصالح للغازات الحقيقية عند الضغوط المنخفضة ودرجات الحرارة المرتفعة، ومن الضروري معرفة أن جهود دالتون كانت خلاصة لمجهود عدد من العلماء مثل روبرت بويل الذي درس العلاقة بين الغاز والحجم بثبات الحرارة أيضًا.[١]
تمكن جون دالتون من التوصل إلى قانونه بعد مجموعة من الاشتقاقات، وفيما يلي تفصيلها وشرح كل منها، يجب العلم أولا بأن الرمز (P) يدل على الضغط (pressure)، وأن الرمز (V) يدل على الحجم (Volume)، أما الرمز (T) فيعني درجة الحرارة (Temperature)، بينما يدل الرمز (R) على ثابت الغازات العام، أما الرمز (n) فيعني عدد الذرات للغاز، والاشتقاقات كالآتي:[٢]
- البدء بمعرفة القانون العام لدالتون وهو يمثل مجموع الضغوط للغاز كما يلي: ( Ptotal = Pa + Pb + ....P).
- الأن وضع القانون العام للغازات على النحو: (PV = nRT).
- يمكن تطبيق قانون دالتون للغازات على عدد المولات استنادًا إلى النظرية الحركية بحيث يساوي العدد الإجمالي للمولات مجموع عدد مولات الغازات الفردية، وذلك بتثبيت قيمة الحجم ودرجة الحرارة إلى جانب الضغط، كما يُمكن حساب الحجم الإجمالي للغاز بنفس الطريقة وهو ما يُنتج المعادلة: (ntotal = na + nb + ....n).
- مع إعادة ترتيب رموز معادلة القانون العام للغازات بغية إيجاد العدد الإجمالي للمولات، فإنه بالإمكان إيجاد كُتل كل عينة من الغاز لإيجاد الضغط الكلي، وذلك عن طريق تحويل الجرامات إلى مولات واستخدام قانون دالتون لإيجاد الضغط، لينتج: (Ptotal V = ntotal RT)؛ وهذا القانون سوف يعطي نفس قيم الضغط الكلي الناتج بعد جمع كل الضغوط الغازية في الحيز مباشرة بواسطة قانون دالتون.
- يمكن إيجاد النسبة المولية (Xi) للغاز، وهي مسؤولة عن وصف جزء الخليط الذي يُمثل غازًا معينًا، وذلك ما يؤدي إلى القانون المشتق عن قانون دالتون: (Vi /Vtot) = (ni /ntot) = (Pi /Ptot) =(Xi).
مسائل محلولة على قانون دالتون للضغوط الجزئية
هل هنالك أي تطبيقات رياضية على قانون دالتون للضغوط الجزئية؟ بالطبع، ولقد ساهمتْ في التعرف على حجوم الغازات وضغطها ودرجة حرارتها عند تثبيت بعض العوامل وتغير بعضها الآخر، وفيما يلي مسائل محلولة على ذلك:
السؤال الأول (1)
نص السؤال: على فرض أن هنالك خليطًا من الغازات يتكون من غاز الهيدروجين (H2) بقيمة 6.7 مول، ومن 3.3 مول من غاز الأكسجين (O2)، وهو موضوع في وعاء ذو حجم مقداره 300 لتر، وعند درجة حرارة مقدارها 273 كلفن، ومقدار الضغط الكلي للغاز هو 0.75 ضغط جوي، فكم يساوي ضغط غاز الهيدروجين لوحده علمًا بأن قيمة الثابت العام للغازات هي R= 0.08206 بوحدة ((ضغط جوي×لتر)/(مول×كلفن))؟[٣]
الحل: سيكون الضغط الجزئي للهيدروجين هو الضغط ذاته حتى مع وجود غازات أخرى في الحاوية وذلك لأن جزيئات الغاز في الوضع المثالي للغاز تتصرف باستقلالية عن الغازات الأخرى في الخليط، وعليه يمكن التعامل مع الهيدروجين فقط وتجاهل الأوكسجين، وبعد تطبيق قانون دالتون للغازات فإن؛ (PH2V = nH2RT)، وبعد إعادة الترتيب للمعادلة؛ ( PH2 = nH2RT /V)، وبالتطبيق:
ضغط الغاز يساوي (PH2 = 6.7× 0.08206 ×273 /300) = (0.5) ضغط جوي.
السؤال الثاني (2)
نص السؤال: على فرض أن هنالك وعاءً بحجم 24 لتر ويحتوي على غاز النيتروجين (N2) عند ضغط مقداره 2 ضغط جوي، وأن هنالك وعاءً آخر بحجم 12 لتر يحتوي على غاز الأكسجين (O2) عند ضغط مقداره 2 ضغط جوي، مع العلم أن درجة الحرارة عند كلا الغازين تساوي 273 كلفن، فما هو مقدار الضغط الكلي للغازين في وعاء بحجم 10 لتر، علمًا بأن قيمة الثابت العام للغازات هي R= 0.08206 بوحدة ((ضغط جوي×لتر)/(مول×كلفن))؟[٣]
الحل: يكون على خطوتين؛ ففي الخطوة الأولى يجب إيجاد عدد ذرات الغازين باتباع القانون: (n= PV /RT)، وعند تطبيقه لغاز النيتروجين فإن المعادلة تعطي:
(2.14 مول =nN2 = 2× 24/ 0.08206 ×273).
أما لغاز الأكسجين فالمعادلة تصبح: (1.07 مول=nO2 = 2× 12/ 0.08206 ×273).
ثم الانتقال للخطوة الثانية وتطبيق القانون: (PV = nRT) تارة لغاز الأكسجين وتارة لغاز الهيدروجين مع الانتباه إلى أن الحجم هو 10 لتر، لينتج ما يلي:
ضغط غاز النيتروجين = (2.14 × 0.08206 × 273 / 10) = (4.79 ضغط جوي).
ضغط غاز الأكسجين = (1.07 × 0.08206 × 273 / 10) = (2.40 ضغط جوي).
قيمة ضغط الغازين معًا = (4.79 + 2.40) = (7.19 ضغط جوي).
السؤال الثالث (3)
نص السؤال: وُضع حوالي 0.750 لترًا من غازٍ ما فوق الماء، وذلك عند درجة حرارة مقدارها 23.0 درجة مئوية، وبضغط إجمالي يساوي 99.75 كيلو باسكال، فكم يساوي ضغط الغاز الجاف، علمًا بأن قيمة الثابت العام للغازات هي R= 0.08206 بوحدة ((ضغط جوي×لتر)/(مول×سيلسيوس))، وأن عدد المولات للغاز تساوي 1.116 مول؟[٤]
الحل: البدء بالعثور على ضغط الغاز باتباع القانون (PV = nRT)، وبتطبيق الأرقام فإن: ( P = 1.116 × 0.08206 ×23.0 /0.750) = 2.8104 كيلو باسكال.
من ثم طرح مقدار الضغطتين من بعضهما لإيجاد قيمة ضغط الغاز الجاف فقط على النحو: 99.75 - 2.8104 = 96.94 كيلو باسكال.
تطبيقات على قانون دالتون للضغوط الجزئية
هل هنالك تطبيقات عملية لقانون دالتون للضغوط الجزيئية في الحياة الواقعية؟ الإجابة هنا بكل تأكيد أجل، بل إنها عديدة ويمكن العثور عليها في العديد من المواضع من حولنا، وفيما يلي اثنين من أبرزها:[٥]
- الغوص تحت الماء: يشير قانون دالتون إلى تأثير الضغط الجزئي على الغواصين، فكلما نزل الغواص في أعماق أكبر زاد معدل الضغط المتركز عليه، وذلك قد يُحدِث أضرارًا جسيمة عند الأعماق الشديدة، مما يستوجب أخذ الاحتياطات بعين الاعتبار مثل فيما يتعلق بأسطوانة الغازات وتركيز وضغط الاكسجين والنيتروجين فيها.
- تقطير المحاليل: تختلف المخاليط السائلة تبعًا لتفاعلها مع الماء؛ فبعضها قابل للمزج وبعضها الآخر غير قابل للمزج مثل المواد العضوية مثلًا، ويُخضع قانون دالتون للغازات تلك المخاليط للضغط الجزئي الذي ينص على أن ضغط بخار الخليط يساوي مجموع ضغوط البخار للمكونات الفردية مجتمعة، وعند تسخين خليط من السوائل غير القابلة للمزج، فإنه سوف يغلي عند حرارة أقل من درجة الغليان الخاصة بالمكونات الفردية مما يساعد على تقطيرها والحصول على المواد المطلوبة.
الخلاصة
توصل جون دالتون عام 1801 لقانون الضغوط، بعدما بنى عمله فوق مجهود عدد من العلماء مثل روبرت بويل، ويستخدم القانون إلى يومنا هذا للغازات الحقيقية عند الضغوط المنخفضة ودرجات الحرارة المرتفعة، ومن أبرز الأمثلة على هذا القانون، تركيز وضغط الغازات في أسطوانات التنفس للغواصين، وتقطير المخاليط.
المراجع
- ^ أ ب The Editors of Encyclopaedia Britannica (1/6/2017), "Dalton's law", Britannica, Retrieved 18/6/2021. Edited.
- ↑ [https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Physical_Properties_of_Matter/States_of_Matter/Properties_of_Gases/Gas_Laws/Dalton's_Law_(Law_of_Partial_Pressures) "Dalton's Law (Law of Partial Pressures)"], The LibreTexts libraries, 16/8/2020, Retrieved 18/6/2021. Edited.
- ^ أ ب "Dalton's law of partial pressure", Khan Academy, Retrieved 18/6/2021. Edited.
- ↑ "Dalton's Law of Partial Pressures", Chem Team, Retrieved 18/6/2021. Edited.
- ↑ "Modern Uses and application", sites google, Retrieved 18/6/2021. Edited.