محتويات
نبذة عامة حول قانون هنري للغازات
يُعتبر قانون هنري الكيميائي أحد القوانين الخاصة بالغازات وقد وُضع من قبل العالم وليام هنري عام 1803م، وصاغ هذا القانون بعد إجرائه العديد من التجارب في أوائل القرن التاسع عشر والتي تختص بكمية الغازات التي تمتصها المياه، حيث كان القانون هو الوصف النهائي لهذه التجارب.[١]
كما قدّم مساهمات أخرى كأبحاث خاصة بتحليل الغازات، وغاز المناجم، وغاز الإضاءة، وتكوين حمض الهيدروكلوريك وأمونياك، والقوى التطهيرية للحرارة، كما أنشأ كتاباً باسم عناصر الكيمياء التجريبية، وقد لاقى انتشاراً كبيراً في العالم.[٢]
نص قانون هنري للغازات
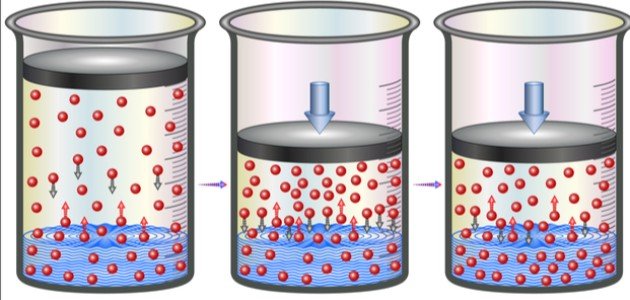
ينص القانون على أنّ درجة الحرارة الثابتة تتناسب مع كمية الغاز المذاب في سائل معلوم النوع والحجم تناسباً طردياً مع الضغط الجزئي، لذلك فإنّ الغاز يكون طافياً فوق السائل، أي أنّ القانون يفسّر أنّ انحلالية الغاز في السائل تتناسب تناسباً طردياً مع الضغط الجزئي للغاز فوق ذلك السائل.[٣]
شرح قانون هنري للغازات
يُمكن توضيح قانون هنري للغازات عن طريق شرح مثال عملي من الحياة اليومية وهو المشروبات الغازية المكربنة، فقبل فتح زجاجة المشروب الغازي، تكون المادة الموجودة فوق السائل هي غاز ثاني أكسيد الكربون النقي، وذلك عند ضغط أعلى قليلاً من قيمة الضغط الجوي، مع العلم أنّ السائل نفسه يحتوي على غاز ثاني أكسيد الكربون المذاب، وعند فتح الزجاجة ينطلق الغاز مُنتجاً صوتاً مميزاً.[٤]
وبما أنّ الضغط الجزئي لغاز ثاني أكسيد الكربون فوق السائل يكون أقل من ضغط السائل، يخرج الغاز المذاب في السائل على شكل فقاعات، وعند ترك وعاء السائل مكشوفاً فإنّ تركيز غاز ثاني أكسيد الكربون الموجود في الوعاء يُصبح في حالة اتّزان مع غاز ثاني أكسيد الكربون الموجود في الجو، وبالتالي يفقد السائل غازيتة، أي يُصبح سائلًا عادياً وغير غازي.[٤]
قانون هنري للغازات رياضياً
يُمكن تمثيل قانون هنري للغازات رياضياً عند ثبات درجة الحرارة كالتالي:[٤]
الضغط الجزئي = ثابت هنري × تركيز الغاز
وبالرموز:
ض = ثابت هنري × ت
وبالرموز الإنجليزية:
P = KH × C
إذ إن:
- P أو ض: الضغط الجزئي للغاز فوق السائل ويقاس بوحدة (atm).
- KH أو ثابت هنري: ثابت قانون هنري للغازات، وهو يختلف من غاز لآخر ويقاس بوحدة (atm.L.mol-1)، ويعتمد هذا الثابت على السائل المذيب، والغاز المذاب، ودرجة الحرارة المقاسة.
- C أو ت: تركيز الغاز ويقاس بوحدة مول / لتر أو (mol/L).
وفيما يلي بعض قيم ثابت هنري للغازات الذائبة في الماء وعند درجة حرارة 298 كلفن:[٥]
اسم الغاز | ثابت هنري للغازات (atm. لتر/ مول) |
الأكسجين (O2) | 769.23 |
ثاني أكسيد الكربون (CO2) | 29.41 |
(H2) | 1282.05 |
أمثلة رياضية على تطبيق قانون هنري
لا بد من ذكر بعض الأمثلة لتوضيح قانون هنري وكيفية تطبيقه، وفيما يلي بعض الأمثلة التي تساعد على ذلك:[٦]
مثال 1: احسب قابلية ذوبان الأكسجين الغازي في الماء عند درجة حرارة 293 كلفن، عندما يكون الضغط الجزئي الذي يبذله جزيء O2 هو 1 بار، علمًا بأن ثابت هنري أو kH للأكسجين = 34840 bar.L.mol-1)؟
الحل:
- وفقًا لقانون هنري: الضغط الجزئي = ثابت هنري × تركيز الغاز
- ثم وبالتعويض بالقانون: 1 = 34840 × ت
- ت = 1 / 34840
- ت = 2.87 × 10-5 مول/ لتر.
مثال 2: إذا كانت قيمة KH لثاني أكسيد الكربون عند درجة حرارة 293 كلفن هي 1.6 × 103 atm لتر/ مول، فعند أي ضغط جزئي يكون للغاز قابلية ذوبان (في الماء) تبلغ 2 × 10-5 مول / لتر؟
الحل:
- تعوض القيم المعطى في القانون هنري كما يلي: ض = ثابت هنري × ت
- ض = 1.6 × 103 × 2 × 10-5
- ض = 0.032 ضغط جوي (1 ضغط جوي تقريبًا تساوي 1 بار)
مثال 3: ما هو تركيز الأكسجين المذاب عند 50 درجة مئوية (سيلسيوس) تحت ضغط مقداره 1 ضغط جوي، وكان الضغط الجزئي للأكسجين عند 50 درجة مئوية يساوي 0.14 ضغط جوي، مع العلم أن ثابت قانون هنري للأكسجين يساوي مول / دسم3 . ضغط جوي 1.3×10−3.[٧]
الحل:
- بالتطبيق على القانون: ض = ثابت هنري × ت
- 0.14 ضغط جوي = 1.3×10−3 (مول / دسم3 . ضغط جوي) × ت (كما يلاحظ بأن الوحدات غير متناسبة أو متطابقة على طرفي المعادلة، وهنا يجب التلاعب قليلًا في القانون لكي يصبح مناسبًا للوحدة المستخدمة وتبعًا لذلك سوف يصبح القانون كما يلي:)
- ت = ثابت هنري × ض
- ت = 0.14 ضغط جوي × 1.3×10−3 (مول / دسم3 .ضغط جوي)
- ت = 1.82×10−4 (مول / دسم3)
ملاحظة: يستنتج مما سبق أن كتلة الغاز المذاب في حجم معين من المذيب عند التوازن تتناسب طرديًا مع الضغط الجزئي للغاز.[٨]
مثال 4: ما هو ثابت هنري للنيون المذاب في الماء، عند العلم بأنّ تركيز المحلول هو 23.5 مل/لتر، والضغط على سطح المحلول يعادل 1 ضغط جويّ، علمًا بأنّ الحجم الموليّ القياسيّ هوَ 22414 مل/ مول.[٩]
الحل:
- قبل تطبيق قانون هنري يجب تحويل تركيز المحلول من مل/لتر إلى مول/لتر، وذلك بقسمة قيمة تركيز المحلول على الحجم الموليّ القياسيّ كما يلي:
- 23.5 (مل/لتر) / 22414 مل/مول = 0.00105 مول/ لتر
- الآن نستطيع تطبيق قانون هنري: ض = ثابت هنري × ت
- 1 ضغط جوي = ثابت هنري × 0.00105 مول/لتر
- بقسمة الطرفين على 0.00105 فإنّ K تساوي 952.4 ضغط جوي. لتر/ مول.
تطبيقات قانون هنري للغازات
يستخدم القانون في الكثير من التطبيقات في الحياة اليومية ومنها ما ساعد على حماية العديد من الأرواح، وفيما يلي البعض منها:
قانون هنري في المشروبات الغازيّة
تغلق زجاجات المشروبات الغازية عند ضغط عالٍ مما يزيد من قابلية ذوبان ثاني أكسيد الكربون فيها، وهذا تطبيق مباشر على قانون هنري.[١٠]
قانون هنري في الغطس
يتعرض جسد الغطاس لضغط مرتفع تحت الماء، مما يدفع أنسجة جسمه إلى امتصاص المزيد من الغازات، وهو ما قد يهدد حياة الغطاس، وتزداد الخطورة بزيادة العمق لأن الضغط عندها يزداد، لذلك عندما يقترب الغواص من القاع تمتص أنسجة الجسم المزيد من النيتروجين. [١٠]
وبالتالي فإن قانون هنري يستخدم للتقليل من مخاطر انخفاض الضغط أثناء الغوص، وذلك من خلال تحديد كميّة الأكسجين المذاب والنيتروجين المناسب لهم، ولحماية الغواصين من مثل هذه الحالة، يتم تحميل المياه المستخدمة من قبل الغواصين بهواء مخفف يحتوي على 11.7% هيليوم، و56.2% نيتروجين، و32.1% أكسجين.[١٠]
قانون هنري في المرتفعات العالية
لا يكون الوزن الجزئي للأكسجين على المرتفعات بنفس القدر على مستوى سطح الأرض، وهذا يقلل من تركيز الأكسجين في الدم والأنسجة للأفراد الموجودين على ارتفاعات عالية أو المتسلقين، وهذا هو السبب في شعورهم بالضعف العام وعدم القدرة على التركيز أو التفكير بوضوح، ويستخدم قانون هنري لقياس الضغط المناسب وتحديد نسبة الأكسجين المطلوبة على هذه المرتفعات.[١٠]
المراجع
- ↑ "Henry's law", britannica, Retrieved 10/11/2021. Edited.
- ↑ "William Henry", encyclopedia, Retrieved 10/11/2021. Edited.
- ↑ "Henry's Law", libretexts, Retrieved 10/11/2021. Edited.
- ^ أ ب ت "What is Henry’s Law?", byjus, Retrieved 10/11/2021. Edited.
- ↑ "Dissolved Oxygen and Carbon Dioxide", butane.chem.uiuc, Retrieved 10/11/2021. Edited.
- ↑ "chemistry/henrys-law", BYJUS, Retrieved 29/9/2021. Edited.
- ↑ "Question", Toppr, Retrieved 1/10/2021. Edited.
- ↑ "Questions", Vedantu, Retrieved 30/9/2021. Edited.
- ↑ "ask/question", Toppr, Retrieved 30/9/2021. Edited.
- ^ أ ب ت ث "Chemistry/Solutions/1365/Applications-of-Henrys-law", Exam Fear, Retrieved 29/9/2021. Edited.