محتويات
نص قانون هنري للغازات
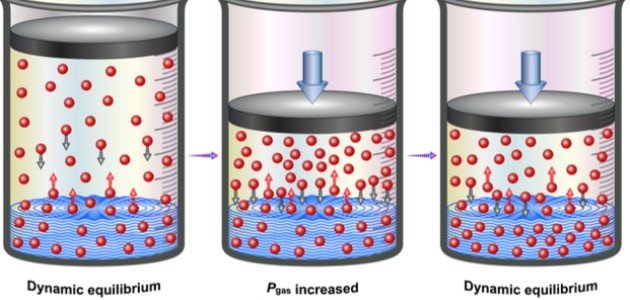
ينصّ القانون على أنّ وزن أو كمية الغاز المذاب في سائل ما تتناسب طرديًا مع ضغط الغاز في السائل،[١] أو بصيغة أخرى أنّه عند درجة حرارة ثابتة فإنّ وزن الغاز المذاب في حجم سائل معيّن تتناسب طرديّا مع الضغط الجزئيّ للغاز في حالة التوازن مع السائل،[٢] ولذلك فإنّ ذوبان الغاز في السائل يتأثّر كثيرًا بدرجة حرارة المحلول، وضغط الغاز الخارجي على سطح المحلول، فكلّما ازداد الضغط الواقع على المحلول فإنّ كميّة الغاز المذاب داخله ستزداد،[٣] وصيغَ قانون هنري عام 1803م على يد الطبيب والكيميائيّ البريطانيّ وليام هنري.[٤]
صيغة قانون هنري للغازات
يمكن صياغة القانون بصورته الرياضيّة كما يلي:
P= KC
بحيث يدلّ الرمز C على تركيز الغاز المذاب ووحدته (مول/لتر)، بينما يدلّ الرمز P على الضغط الجزئيّ للغاز فوقَ المحلول ووحدته هيَ ضغط جوي atm، أما الرمز K فهو ثابت قانون هنري ووحدته ضغط جوي atm/(مول/لتر)، وهيَ قيمه تختلف من محلول لآخر.[٢]
مسائل محلولة على قانون هنري للغازات
- كم غراماً من غاز ثاني أكسيد الكربون المذاب في زجاجة من المياه الغازيّة سعتها 1 لتر، في حال أنّ الشركة المصنعة تستخدم ضغط يبلغ مقداره 2.4 ضغط جوي في عمليّة التعبئة وفي درجة حرارة تبلغ 25 درجة مئويّة، علماً بأنّ ثابت هنري لمحلول الماء مع ثاني أكسيد الكربون عندَ درجة حرارة 25 درجة مئويّة هوَ 29 ضغط جوي/(مول/لتر).[٥]
المعطيات: P= 2.4 atm ، K=29 atm/(mol/L)
المطلوب: إيجاد وزن غاز ثاني أكسيد الكربون.
الحلّ: نطبق قانون هنري P=KC ونعوض القيم المعلومة في المعادلة كما يلي:
2.4atm = 29 atm/ C (mol/L)
وبعد الضرب التبادلي والقسمة فإن القانون سوف يعطي قيمة C = 0.08 mol/L
وحيث أنّ لدينا لتر واحد من الماء فإنّ وزن الغاز المذاب هو 0.08 mol لكل لتر.
وللتحويل من مول إلى غرام فعليك ان تعلم بأن كل 1 مول من غاز ثاني أكسيد الكربون يساوي 44 غرام.
وبالتالي فإنّ وزن الغاز بالغرام= 0.08*44= 3.52 غرام
أي أنّ 3.52 غرام من غاز ثاني أكسيد الكربون ذائب في 1 لتر من الماء.
- ما هو ثابت هنري للنيون المذاب في الماء، عند العلم بأنّ تركيز المحلول هو 23.5 ميليلتر/لتر، والضغط على سطح المحلول يعادل 1 ضغط جويّ؟ ثمّ احسب الذوبان المولي في الماء المشبع بغاز النيون، علماً بأنّ الحجم الموليّ القياسيّ هوَ 22.414 ميليلتر/ مول، وفي حال كان ضغط غاز النيون يعادل 0.0341 ضغط جويّ.[٦]
المعطيات: P= 1 atm ، C=23.5 ml/L
المطلوب: إيجاد قيمة K لغاز النيون.
الحلّ: قبل تطبيق قانون هنري يجب تحويل تركيز المحلول من ميليلتر/لتر إلى مول/لتر، وذلك بقسمة قيمة تركيز المحلول على الحجم الموليّ القياسيّ
23.5(مل/لتر)/ 22.414 مل/مول = 1.05 مول/ ميللتر، ثم عليك قسمة الناتج على 1000 لتحويلها إلى لتر ليصبح الناتج يساوي 0.00105 مول/لتر
الآن نستطيع تطبيق قانون هنري P=KC ، 1atm=K×0.00105mol/L
بقسمة الطرفين على 0.00105 فإنّ K تساوي 952.4 atm/(مول/لتر)
- إذا كانت قيمة ثابت هنري لغاز ثاني أكسيد الكربون تعادل (3)^10×1.6 (مول/لتر)/ضغط جويّ، عند أي ضغط جزئيّ يكون للغاز قابلية ذوبان (في الماء) تصل إلى (5-)^10×2 مول/لتر؟[٧]
المعطيات: (3)^10×K=1.6 ، و (5-)^10×C=2
المطلوب: إيجاد قيمة P
الحلّ: نطبّق قانون هنري بوضع المعطيات فيه كما يلي:
((5-)^10×2)×((3)^10×P=KC ، P=(1.6
وبذلك فإنّ P = 0.032 atm
- احسب قابليّة ذوبان الأكسجين عند درجة حرارة 293 كلفن عندما يكون الضغط الجزئيّ يعادل 1 بار، علمًا بأنّ ثابت هنري للأكسجين الذائب في الماء هوَ 34840 بار/(مول/لتر).[٧]
المعطيات: P= 1 bar ، K=34840 bar/(mol/L)
المطلوب: إيجاد قيمة C
الحلّ: نطبّق قانون هنري بتعويض المعطيات كما يلي:
P=KC، 1= 34840 × C
وبالتالي فإنّ قيمة C تساوي بعد القسمة (5-)^10×2.87 مول/لتر، ولا حاجة للتحويل هنا من بار إلى ضغط جوي لأن القسمة ألغت وحدة الضغط الجوي من الأساس.
تطبيقات على قانون هنري
يلاحظ استخدام قانون هنري في التطبيقات الحياتيّة التالية:
قانون هنري في المشروبات الغازيّة
وضعت الشركات المصنّعة للمشروبات الغازيّة غاز ثاني أكسيد الكربون داخل علب المشروبات بصورته الذائبة، ويكون ضغط الغاز داخل العلبة أعلى قليلاً من الضغط الجويّ، لذلك عندما تفتح العلبة يخرج بعض من الغاز المضغوط فيصدر صفير من العلبة، ويستمرّ خروج الغاز من العلبة على شكل فقاعات غازيّة في المشروب لأنّ ضغط الغاز فوقَه أصبحَ أقلّ وينتهي الأمر بحالة التعادل بين الغاز في المشروب وفي الهواء الخارجي.[٨]
قانون هنري في التنفس
يطبّق قانون هنري على فسيولوجيا الجهاز التنفسيّ في الإنسان، فهوَ يوضّح كيفيّة إذابة الغازات أثناء تبادلها في الحويصلات الهوائيّة ومجرى الدم، فمن المعروف أنّ الضغط الجزئيّ للأكسجين في الحويصلات يكون أعلى منه في الدم منزوع الأوكسجين، وبالتالي فإنّ الأكسجين يميل للذوبان في الدم غير المؤكسد، وبحسب قانون هنري تتناسب كميّة الأكسجين التي تذوب في مجرى الدم طرديًا مع الضغط الجزئيّ للأكسجين في هواء الحويصلات، وفي المقابل يكون ضغط غاز ثاني أكسيد الكربون أكبر في الدم منزوع الأوكسجين، فينتقل من مجرى الدم إلى الحويصلات ليتحوّل مرّة أخرى لشكله الغازيّ حتى تتخلص الرئة منه.[٨]
قانون هنري للغوّاصين
يستخدم قانون هنري في التقليل من مخاطر انخفاض الضغط أثناء الغوص، وذلك من خلال تحديد كميّة الأكسجين المذاب والنيتروجين في دم الغوّاصين.[٢]
ما العوامل المؤثرة في ثابت قانون هنري؟
تتأثّر قيمة ثابت قانون هنري بعدد من العوامل، والتي يمكنك التعرف عليها من خلال النقاط التالية:[٧]
- درجة الحرارة.
- الضغط الواقع على المحلول.
- طبيعة الغاز المذاب أو نوعه.
- طبيعة المذيب أو نوعه.
الخلاصة
يستخدم قانون هنري لحساب كمية الغاز المذاب في السائل، أو الضغط الذي يشكله الغاز على سطح السائل، ويعتمد القانون على وجود ثابت يسمى ثابت هنري (K)، وهو ثابت تختلف قيمته حسب نوع الغاز المذاب، وتوجد عدة تطبيقات مهمة للقانون مثل المشروبات لغازية والغوص وغيرها، ويتأثر القانون بعوامل مثل الحرارة والضغط وطبيعة الغاز وطبيعة السائل.
المراجع
- ↑ "Henry's law", Britannica, 20/7/1998, Retrieved 12/6/2021. Edited.
- ^ أ ب ت Todd Helmenstine (27/2/2020), "Henry's Law Example Problem", ThoughtCo, Retrieved 12/6/2021. Edited.
- ↑ "What is Henry's law constant", Study.com, Retrieved 12/6/2021. Edited.
- ↑ "William Henry", Encyclopedia, Retrieved 12/6/2021. Edited.
- ↑ Dr Zifei Liu, Physical Principles of Environmental Systems, Page 21- 24. Edited.
- ↑ "Henry's Law", The LibreTexts libraries, 17/2/2021, Retrieved 17/6/2021. Edited.
- ^ أ ب ت "Henry's Law", BYJU's Classes, Retrieved 13/6/2021. Edited.
- ^ أ ب "Gas Laws", Lumen Learning, Retrieved 13/6/2021. Edited.