محتويات
قواعد التوزيع الإلكتروني للعناصر
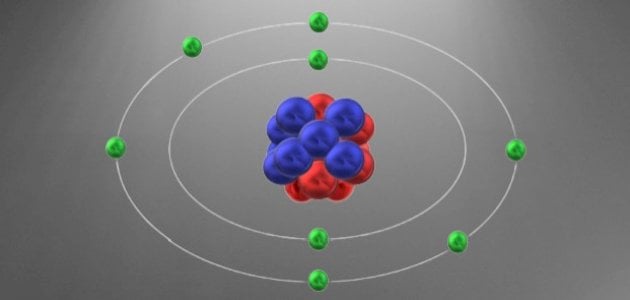
يعبر التوزيع الإلكتروني (Electron configuration) للعنصر عن كيفية ترتيب الإلكترونات في الذرّة حول النواة، حيث إن الإلكترونات تتوزع بشكل دائري في مدارات حول النواة، ولكل مدار بُعد ثابت عن النواة، ويمكن معرفة آلية توزيع الإلكترونات في مداراتها من خلال القواعد الآتية:[٢]
ترتيب المدارات
يرمز للمدار الأول والأقرب إلى النواة بالرمز (k)، والمدار الثاني (L)، والمدار الثالث (M)، أما المدار الرابع فيرمز له بالرمز (N).[٢]
التوزيع الإلكتروني
يتم توزيع الإلكترونات في المدارات بالترتيب بدءًا من المدار الأول K ثم المدار الثاني L ثم الثالث M ومن ثم N، حيث لا يمكن ملء مدار إلا باكتمال المدار الذي قبله، ومن الجدير بالذكر أنه ليس بالضرورة أن تمتلئ جميع المدارات بالإلكترونات، فهذا يختلف تبعاً للعنصر حيث إن العناصر المختلفة تمتلك أعداد إلكترونات مختلفة.[٢]
سعة المدارات
سعة المدار هي قدرة المدار على احتواء عدد معين من الإلكترونات، فأكبر عدد إلكترونات يمكن أن يتواجد في المدار هو نتاج 2n2، حيث أن n يرمز إلى رقم المدار، ومن هنا يمكن معرفة أكبر سعة ممكنة لكل مدار كما يلي:[٣]
- أكبر سعة إلكترونية للمدار الأول K هي 2(1)2 وتساوي إلكترونين.
- أكبر سعة إلكترونية للمدار الثاني L هي 2(2)2 وتساوي 8 إلكترونات.
- أكبر سعة إلكترونية للمدار الثالث M هي 2(3)2 وتساوي 18 إلكترون.
- أكبر سعة إلكترونية للمدار الرابع N هي 2(4)2 وتساوي 32 إلكترون.
مستويات الطاقة
تختلف مستويات الطاقة بين كل مدار بالترتيب، بمعنى أن مستوى الطاقة يزيد بالانتقال من المدار الأول فالثاني فالثالث وهكذا، حيث إن المدار K يمتلك أقل مستوى طاقة، ومدار L يمتلك مستوى طاقة أعلى وهكذا، وبناءً على ما سبق فإن مستوى الطاقة يزداد بشكل تصاعدي، ويتم توزيع مستويات الطاقة كالآتي:[٢]
- مستوى الطاقة الأول والأقل في المدار K.
- مستوى الطاقة الثاني في المدار L.
- مستوى الطاقة الثالث في المدار M.
- مستوى الطاقة الرابع والأعلى في المدار N.
المدارات الفرعية
لكل مدار رئيسي حول النواة مدارات فرعية، بحيث تختلف أعداد هذه المدارات الفرعية باختلاف المدار الرئيسي كما يلي:[٤]
- المدار الأول: يمتلك مدار فرعي واحد يطلق عليه 1s.
- المدار الثاني: يحتوي على مدارين فرعيين 2s و 2p.
- المدار الثالث: يحتوي على ثلاثة مدارات فرعية وهي 3s و 3p و 3d.
- المدار الرابع: يحتوي على أربعة مدارات فرعية وهي 4s و 4p و 4d و 4f.
السعة الإلكترونية للمدارات الفرعية
يمكن معرفة السعة الإلكترونية لكل من المدارات الفرعية من خلال الصيغة: 2*(2l + 1)، حيث أن l يمثل عدداً كميّاً تابعاً لعدد المدارات الفرعية كالآتي:[٤]
- في المدار الأول الذي يحتوي على مدار فرعي واحد i يساوي صفر في 1s.
- في المدار الثاني الذي يحتوي على مدارين فرعيين فإن i يساوي صفر في 2s ويساوي 1 في 2p.
- في المدار الثالث الذي يحتوي على ثلاثة مدارات فرعية فإن i يساوي صفر في 3s وواحد في 3p واثنين في 3d.
- في المدار الرابع الذي يحتوي على أربعة مدارات فرعية فإن i يساوي صفر في 4s وواحد في 4d واثنين في 4p وثلاثة في 4f.
أكبر عدد إلكترونات يمكن أن تسعه المدارات الفرعية
بناءً على ما سبق يمكن حساب أكبر عدد إلكترونات تتسع لها المدارات الفرعية بتعويض قيمة i في المعادلة كما يلي:[٤]
- عدد إلكترونات في المدار s تساوي 2*(2l + 1) = 2*(2(0) + 1) = إلكترونان.
- عدد الإلكترونات في المدار p تساوي 2*(2l + 1) = 2*(2(1) + 1) = ستة إلكترونات.
- عدد الإلكترونات في المدار d تساوي 2*(2l + 1) = 2*(2(2) + 1) = عشرة إلكترونات.
- عدد الإلكترونات في المدار f تساوي 2*(2l + 1) = 2*(2(3) + 1) = أربعة عشر إلكترون.
المراجع
- ↑ Anne Marie Helmenstine, Ph.D. (21/9/2019), "definition-of-atom-and-examples", thoughtco, Retrieved 20/1/2022. Edited.
- ^ أ ب ت ث "electrons-distributed-orbits-shells-electronic+configuration", toppr, Retrieved 17/1/2022. Edited.
- ↑ "electron-configuration", byjus, Retrieved 17/1/2022. Edited.
- ^ أ ب ت "electron-configuration", byjus, Retrieved 18/1/2022. Edited.