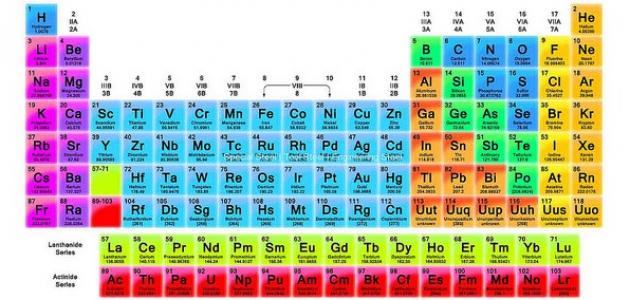
الجدول الدوري
إنّ الجدول الدروي للعناصر هو عبارة عن جدولٍ منظمٍ يحتوي على العناصر الكيميائية المكتشفة، حيث تُرتب هذه العناصر نسبةً لأعدادها الذرية، كمت ترتب العناصر المتشابهة في الخصائص في نفس العمود والصف، لذلك فهو يعد من أهم الوسائل المستخدمة في علم الكيمياء خاصةً والعلوم الأخرى عامةً، ويحتوي الجدول الدوري تحديداً على 118 عنصر ولا زال العلماء يبحثون عن عناصر جديدة.
استخدامات الجدول الدوري
ينتشر استخدام الجدول الدوري في المدارس والجامعات، ومراكز الأبحاث العلمية، وذلك لمعرفة صفات العناصر الكيميائية والفيزيائية، حيث يوضح الجدول كافة المعلومات المتاحة الخاصة بالعناصر مما يوفر الوقت والجهد المستهلكان في الحصول على هذه المعلومات، ولا يعد الجدول الدوري ثابتاً، بل قد تُضاف له عناصر جديدة في حالة اكتشافها أو معلومات جديدة عن العناصر المكتشفة مسبقاً، وقد اكتشف العلماء مؤخراً 4 عناصر جديدة وسيتم إدراجها في التصنيف الحديث للجدول.
أهمية الجدول الدوري
- معرفة أنواع التفاعلات الكيميائية التي يمكن أن يشارك فيها العنصر.
- معرفة السلوك الكيميائي للعنصر.
- معرفة البنية الإلكترونية لذرة العنصر.
- معرفة موقع العنصر في الدورة أو المجموعة.
خصائص الجدول الدوري
- تشكل العناصر المعدنية النسبة الأكبر من عناصر الجدول الدروي، وهي المعادن القلوية، والمعادن القلوية الترابية، والمعادن الأساسية، والمعادن الانتقالية.
- تسمى صفوف الجدول الدوري باسم الدور، ويتكون الجدول من سبعة دورات.
- يتكون الجدول الدوري من 18 مجموعة، وهي الأعمدة الرأسية.
- تُصنف العناصر في الجدول الدوري نسبةً إلى أعدادها الذرية، حيث يقل الحجم الذري للعنصر كلما انتقلنا من اليسار إلى اليمين في الدورة الواحدة، ويزيد عند الانتقال من الأعلى إلى الأسفل في المجموعة الواحدة.
- تتشابه عناصر المجموعة الواحدة في الخصائص، والتركيب الإلكتروني في المدار الأخير.
- تميل عناصر المجموعة الأولى والثانية والثالثة لفقد الإلكترونات، لتصبح أكثر كهروجابية.
- تميل المجموعة الرابعة والخامسة والسادسة لكسب الإلكترونات، وتصبح أكثر كهروسلبية.
- تنتهي كل دورة في الجدول بعنصر نبيل، ويتميز بأنّه ممتلئ المدار الأخير.
- تحدد إلكترونات التكافؤ، أو عدد إلكترونات المدار الأخير ورقم الدورة التي ينتمي إليها العنصر في الجدول الدوري.
- تقع في أسفل الجدول الدوري سلسلتان طويلتان من العناصر، ويُطلق على السلسلة الأولى لانثانيدات، والثانية الأكتنيدات، وتحتوي كل سلسلة 14 عنصراً، وتنتمي إلى مجموعة العناصر المعدنية الانتقالية.
- تصنف عناصر الجدول الدوري إلى: فلزات (معادن)، ولا فلزات (لامعادن)، وأشباه الفلزات (لها خصائص مشتركة بين النوعين).
- تقل الكهروسلبية عند الانتقال من اليمين إلى اليسار في عناصر الجدول الدروي.