محتويات
ما هي الرابطة الفلزية؟
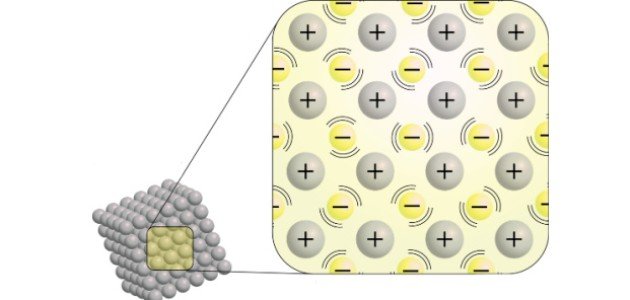
تُعرف الرابطة الفلزيّة بأنّها إحدى الروابط الكيميائيّة التي تربط الذرات مع بعضها البعض في الفلزات، مشكلة بذلك شبكة بلوريّة قوية وكبيرة، حيثُ تحدث نتيجة للحركة الحرة لإلكترونات التكافؤ في الفلزات في جميع أنحاء البلورة بأكملها، وتكوّن الأيونات الموجبة، ثمّ ارتباطها بالأيونات السالبة، مما يؤدي إلى نشوء قوة التماسك والارتباط في البلورة.[١]
خطوات تكون الرابطة الفلزية
يُمكن التعرّف على خطوات تكوّن الرابطة الفلزيّة على النحو الآتي:[٢]
- تفقد ذرة الفلز الإلكترونات في المدار الأخير للذرة، فيتكون أيون موجب الشحنة من الفلز.
- تُطلق الفلزات إلكترونات سالبة الشحنة، تنتنشر بدورها بين الأيونات الموجبة مشكلة سحابة كبيرة بينها.
- ينجذب الأيون الموجب إلى الأيون السالب في الفلز، مما يؤدي لنشوء قوة تماسك وارتباط كبيرين، وهو ما يُعرف بالرابطة الفلزية.
خصائص الرابطة الفلزية
تُشكّل الرابطة الفلزيّة العديد من خصائص الفلزات، وفيما يأتي التعرّف عليها:
الموصلية الكهربائية والتوصيل الحراري
تمتاز الفلزات بموصليتها الكهربائيّة المرتفعة، وهذا نتيجة للحركة الحرة وغير المقيدة للإلكترونات، مما يسمح بمرور التيار والشحنات المكونة له بسهولة، كما تُعتبر الفلزات ذات قدرة على التوصيل الحراريّ كبيرة، وذلك بسبب الطاقة الحركيّة للإلكترونات التي تزداد في الجزء المسخن من الفلز، مما يؤدي إلى تصادمها مع إلكترونات أخرى، ونقل الطاقة بسرعة كبيرة، وبالتالي انتقال الحرارة.[٣]
غير قابلة للكسر
تُعدّ الفلزات من العناصر القوية للغاية، حيثُ إنّها غير قابلة للكسر وغير قابلة للتشوه عند طرقها، وذلك بسبب قوة الرابطة بين الذرات، وقوة الشبكة البلوريّة، وتجدر الإشارة إلى أنّ هذا يُعدّ أحد الأسباب التي يُمكن عن طريقها تحويلها إلى صفائح رقيقة.[٣]
البريق
تمتص الفلزات طاقة الفوتون من الضوء، مما يؤدي إلى إثارة الإلكترونات وزيادة مستويات الطاقة للذرة، وسرعات ما تعود الإلكترونات لحالتها الأصليّة، فيُسبب ذلك انبعاث الضوء والبريق.[٣]
درجة انصهار وغليان مرتفعة
تمتاز الفلزات بقوة الجذب القوية بين ذراتها، بسبب الرابطة الفلزيّة، حيثُ تحتاج الفلزات إلى مقدار كبير من الطاقة للتغلّب على قوة الجذب هذه، مما يجعلها ذات درجة انصهار وغليان مرتفعة.[٣]
التجاذب الكهروستاتيكي والكهروسلبية
تمتاز الفلزات بقوة التجاذب الكهروستاتيكي بين ذراتها، وهذا نتيجة التجاذب الكبير الذي يحدث بين الأيونات الموجبة المتشكلة نتيجة لفقدان الإلكترونات، وتشكّل الأيونات الموجبة، وارتباطها بالإلكترونات السالبة، كما تجدر الإشارة إلى أن الكهروسلبيّة لا تلعب أيّ دور في الفلزات.[٤]
الحالة الفيزيائية وخاصية الذوبان
تكون الفلزات التي تتميز بالرابطة الفلزيّة بين ذراتها بالحالة الصلبة عند درجة حرارة الغرفة، كما أنّها تمتلك القدرة على التفاعل مع بعض العناصر الأخرى في الماء، بينما لا يتفاعل بعضها الأخرى في الماء.[٤]
أمثلة على الرابطة الفلزية
يُمكن الاطلاع على الأمثلة الآتية التي تُمثل الرابطة الفلزيّة:[٥]
- الفلزات القلوية، مثل: البوتاسيوم، والصوديوم.
- الفلزات القلويّة الترابيّة، مثل: الكالسيوم والمغنيسيوم.
- الفلزات الانتقاليّة، مثل: الحديد، والنحاس، والذهب، والزنك.
- السبائك، مثل: البرونز، والفولاذ المقاوم للصدأ.
المراجع
- ↑ Gloria Lotha (22/8/2022), "metallic bond", Britannica, Retrieved 20/11/2022. Edited.
- ↑ Jim Clark (16/8/2020), "Metallic Bonding", LibreTexts CHEMISTRY, Retrieved 20/11/2022. Edited.
- ^ أ ب ت ث "What is a Metallic Bond?", BYJU'S, Retrieved 20/11/2022. Edited.
- ^ أ ب "Ionic, Covalent, and Metallic Bonds – Comparison and Contrast", Chemistry Learner, Retrieved 20/11/2022. Edited.
- ↑ "Metallic Bonding", Chem Talk, Retrieved 20/11/2022. Edited.