قانون دالتون
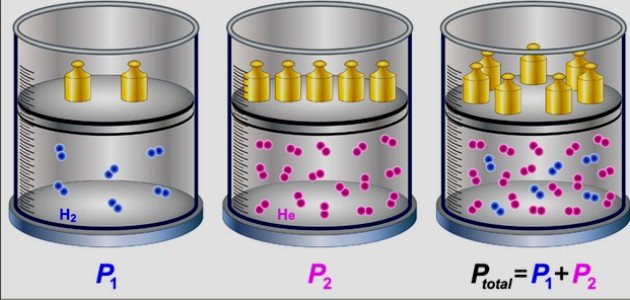
نشر العالم جون دالتون قانونه في الغازات (بالإنجليزية : Dalton's law) عام 1801م، والذي يُسمى بقانون الضغوط الجزيئية (بالإنجليزية: Law of Partial Pressures)، إذ ينص هذا القانون على أن قيمة الضغط الكلي لمزيج من الغازات غير المتفاعلة داخل خليط ما يكون مساويًا لمجموع الضغوط الجزيئية للغازات المكونة لهذا الخليط.[١]
واعتمد دالتون في تفسير قانونه على نظرية حركة الجزيئات (بالإنجليزية: Kinetic theory of gases)، إذ إن الغازات ستنتشر داخل الوعاء الموجودة فيه وستعمل على ملئ الفراغات، وذلك لانعدام الروابط والتفاعلات بين الغازات المتناثرة، ويمكن حساب ضغط الغاز من خلال حدوث تصادمات مع الوعاء الذي توجد فيه، إذ إن كل غاز يمتلك حرية واستقلالية عن غيره.[٢]
وذلك بسبب المسافات الكبيرة بين جزيئات الغازات المختلفة داخل الخليط،[٢] ويمكن التعبير عن قانون دالتون من خلال الصيغة الرياضية الآتية:[٢]
الضغط الكلي= ضغط الغاز الأول + ضغط الغاز الثاني + ضغط الغاز الثالث + .... .
ويمكن التعبير عن قانون دالتون بالإنجليزية:
total pressure= first pressure + second pressure + third pressure + etc
وبالرموز؛ ...+ PT = PA + PB + Pc، إذ إن:[٣]
PT: يمثل الضغط الكلي، ويقاس بوحدة الضغط الجوي (atm).
PA, PB, PC, ... : تمثل الضغوط الجزيئية للغازات المختلفة في الخليط، وتقاس بوحدة الضغط الجوي (atm).
نظرية دالتون الذرية
مثّل دالتون النظرية الذرية (بالإنجليزية: Dalton's Atomic Theory) عام 1805م، فعمل دالتون على تطوير القانون الذي ينص على أن ذرات العناصر تتحد بنسب عددية ثابتة لتكوين المركبات الكيميائية، واستمد دالتون قانونه بشكل رئيس من البيانات التجريبية، وبين أن كل عنصر كيميائي يتكون من نوع واحد من الذرات التي لا يمكن تجزئتها بأي وسيلة كيميائية.[٤]
واستند دالتون على عدة قوانين لتطوير نظريته الذرية، منها:[٤]
- قانون الحفاظ على الكتلة
إذ إن هذا القانون ينص على أن كتلة المواد المتفاعلة تساوي كتلة المواد الناتجة.
- قانون النسب الثابتة
وينص القانون على أن نسبة كتل العناصر في المركب ثابتة.
فروض نظرية دالتون
توصل دالتون إلى بعض الإفتراضات التي تتعلق بالذرة، وليس بالضرورة أن تكون جميع هذه الفرضيات صحيحة، ومن هذه الفرضيات:[٥]
- تتكون المادة من جزيئات صغيرة وتسمى الذرة.
- تعتبر الذرة جسيم غير قابل للتجزئة، إذ لا يمكن تجزئة الذرة أو إنشاؤها من خلال التفاعلات الكيميائية.
- تتشابه جميع خواص ذرات العنصر الواحد الفيزيائية والكيميائية.
- تختلف خواص ذرات العناصر المختلفة في الكتلة وخصائصها الكيميائية.
- تتحد الذرات بنسب صحيحة عند تشكيل المركبات الكيميائية المستقرة كما تتواجد بالطبيعة.
- يكون العدد النسبي وأنواع الذرات لمركب ما ثابتة دائمًا.
عيوب نظرية دالتون
توصل العلماء إلى أن هناك العديد من العيوب في نظرية دالتون الذرية، وذلك بسبب التقدم في العلم، وتطور الأجهزة المستخدمة لاختبار النظريات، وتتلخص هذه العيوب في النقاط الآتية:[٦]
- اكتشاف أن الذرة يمكن تجزئتها إلى إلكترونات، وبروتونات، ونيوترونات.
- اختلاف بعض العناصر في كتلتها وكثافتها، وتسمى هذه العناصر بالنظائر (بالإنجليزية: Isotope)، مثل عنصر الكربون الذي يمتلك نظيران والعدد الكتلي لهما 12 و14.
- اكتشاف العلماء أن بعض العناصر تمتلك نفس الكتلة مع اختلاف نوع ذراتها، وتسمى بمتساويات الكتل (بالإنجليزية: isobar)، مثل عنصر الأرجوان (بالإنجليزية: Argon)، والكالسيوم (بالإنجليزية: Calcium)، فلها كتلة ذرية متساوية.
- اتحاد ذرات بعض المركبات العضوية المعقدة بأعداد غير صحيحة مثل مركب السكر، وتركيبه الكيميائي هو (C12H22O11).[٧]
- عدم قدرة النظرية على تفسير وجود مفهوم التآصل (بالإنجليزية: Allotropy)، ويقصد به وجود أكثر من تركيب بلوري للعنصر الواحد، مثل مادتي الألماس والغرافيت، إذ يتكون كلاهما من عنصر الكربون.
تمكن العالم دالتون من التوصل إلى العديد من الإنجازات المهمة في مجال الكيمياء، منها: وضع قانون يدرس ضغوط الغازات، وأطلق عليه قانون الضغوط الجزيئية، وكان نصه أن الضغط الكلي لخليط من الغازات لا تتفاعل مع بعضها يساوي مجموع الضغوط الجزيئية لهذه الغازات، إذا شغل كل غاز الحيز بمفرده، وقام دالتون أيضًا بوضع النظرية الذرية للمادة.
وتتمكن هذه النظرية من تحديد العناصر الكيميائية التي تبين التركيب الذري لجزيئات المادة، وبين هذا المقال فرضيات النظرية الذرية، وكما وضح العديد من العيوب التي ظهرت مؤخرًا على هذه النظرية.
المراجع
- ↑ "Dalton's law", britannica, Retrieved 2/10/2021. Edited.
- ^ أ ب ت "Dalton's Law (Law of Partial Pressures)", chem.libretexts, Retrieved 2/10/2021. Edited.
- ↑ "Gas Laws", schools.nbisd, Retrieved 2/10/2021. Edited.
- ^ أ ب "A Brief History of Atomic Theory", thoughtco, Retrieved 2/10/2021. Edited.
- ↑ "Dalton's Atomic Theory", brilliant, Retrieved 2/10/2021. Edited.
- ↑ "Structure of carbon allotropes", chem.libretexts, Retrieved 2/10/2021. Edited.
- ↑ "daltons atomic theory postulates, merits and demerits", goyalsacademy, Retrieved 2/10/2021. Edited.